よむ、つかう、まなぶ。
総-2参考3 (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_46580.html |
| 出典情報 | 中央社会保険医療協議会 総会(第599回 12/11)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
各 1 例)、30 mg 投与例 3 例(アナフィラキシー反応、ヘルペス性状湿疹、感染性湿疹各 1 例)について
は、治験薬との因果関係は否定されなかった。
中止に至った有害事象は、15 mg 投与例 7.9%(7/89 例)、30 mg 投与例 4.4%(4/90 例)に認められた。
副作用は、15 mg 投与例 44.9%(40/89 例)、30 mg 投与例 54.4%(49/90 例)に認められた。
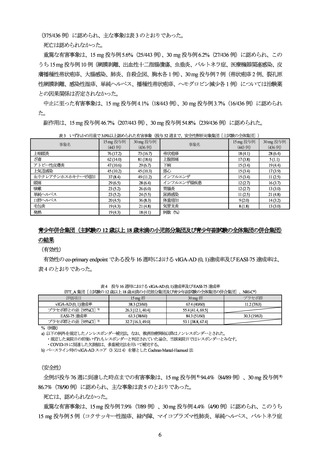
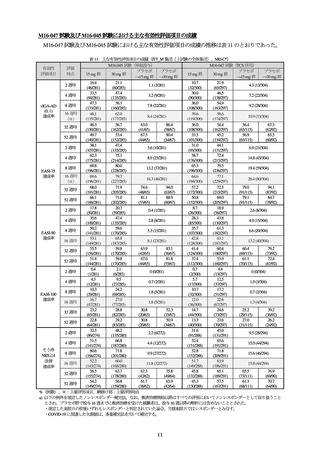
表 5 いずれかの用量で 3.0%以上に認められた有害事象
(投与 76 週まで、全ウパダシチニブ投与集団[主試験の 12 歳以上 18 歳未満の小児部分集団及び青少年副試験の全体集団の併合集団])
本剤 15 mg
本剤 30 mg
本剤 15 mg
本剤 30 mg
事象名
投与例
投与例
事象名
投与例
投与例
(89 例)
(90 例)
(89 例)
(90 例)
ざ瘡
23 (25.8)
28 (31.1)
鼻漏
3 (3.4)
2 (2.2)
ヘルペス性状湿疹
COVID-19
13 (14.6)
11 (12.2)
3 (3.4)
1 (1.1)
アトピー性皮膚炎
12 (13.5)
4 (4.4)
アラニンアミノトランスフェラーゼ増加
3 (3.4)
1 (1.1)
アスパラギン酸アミノトランスフェラー
上咽頭炎
11 (12.4)
13 (14.4)
3 (3.4)
1 (1.1)
ゼ増加
頭痛
血中尿酸増加
10 (11.2)
9 (10.0)
3 (3.4)
0
咳嗽
不規則月経
9 (10.1)
4 (4.4)
3 (3.4)
0
単純ヘルペス
8 (9.0)
3 (3.3)
湿疹
3 (3.4)
0
上気道感染
下痢
7 (7.9)
9 (10.0)
2 (2.2)
5 (5.6)
膿痂疹
ブドウ球菌皮膚感染
6 (6.7)
5 (5.6)
2 (2.2)
5 (5.6)
カタル
5 (5.6)
6 (6.7)
好中球数減少
2 (2.2)
5 (5.6)
血中クレアチンホスホキナーゼ増加
好中球減少症
4 (4.5)
16 (17.8)
2 (2.2)
4 (4.4)
嘔吐
4 (4.5)
7 (7.8)
伝染性軟属腫
2 (2.2)
4 (4.4)
腹痛
咽頭炎
4 (4.5)
6 (6.7)
2 (2.2)
4 (4.4)
悪心
白血球減少症
4 (4.5)
4 (4.4)
2 (2.2)
3 (3.3)
耳感染
4 (4.5)
1 (1.1)
上腹部痛
2 (2.2)
3 (3.3)
尿中蛋白陽性
インフルエンザ様疾患
4 (4.5)
1 (1.1)
2 (2.2)
3 (3.3)
喘息
胃腸炎
4 (4.5)
1 (1.1)
2 (2.2)
3 (3.3)
口腔咽頭痛
4 (4.5)
1 (1.1)
白血球数減少
1 (1.1)
6 (6.7)
そう痒症
ウイルス性上気道感染
4 (4.5)
1 (1.1)
1 (1.1)
4 (4.4)
貧血
4 (4.5)
0
膿疱性ざ瘡
1 (1.1)
3 (3.3)
発熱
帯状疱疹
3 (3.4)
7 (7.8)
1 (1.1)
3 (3.3)
尿路感染
レンサ球菌性咽頭炎
3 (3.4)
6 (6.7)
1 (1.1)
3 (3.3)
リンパ節症
3 (3.4)
3 (3.3)
扁桃炎
0
5 (5.6)
結膜炎
体重増加
3 (3.4)
2 (2.2)
0
4 (4.4)
毛包炎
例数(%)
3 (3.4)
2 (2.2)
国際共同第Ⅲ相試験(M16-045 試験 1))
:単独投与試験
【試験の概要】
TCS 若しくは TCI で効果不十分、AD に対する全身療法の治療歴がある、又は安全性上の理由等から外
用療法が推奨されない AD 患者(主試験:目標例数 810 例〔各群 270 例〕
、青少年副試験:12 歳以上 18 歳
未満の小児 AD 患者の目標例数 180 例 2)〔各群 60 例〕
)を対象に、プラセボに対する本剤の優越性及び安
全性を検討するため、プラセボ対照無作為化二重盲検並行群間比較試験が日本、米国、カナダ等の 24 の国
又は地域9)で実施された。
本試験は 2 期(二重盲検期:投与 16 週まで、継続投与期:投与 16 週以降 260 週まで)から構成され、
用法・用量は、二重盲検期では本剤 15 mg、30 mg 又はプラセボを、継続投与期では、二重盲検期に本剤が
投与された被験者は二重盲検期と同じ用量の本剤を、二重盲検期にプラセボが投与された被験者は本剤
15 mg 又は 30 mg をそれぞれ 1 日 1 回経口投与することと設定された。ベースライン時の 7 日以上前から
投与 16 週まで保湿外用薬を 1 日 2 回併用することとされ、投与 4 週以降に症状の改善が不十分な場合10)
9)
10)
このうち日本を含む 20 の国又は地域で 12 歳以上 18 歳未満の AD 患者が組み入れられた。
医師により救済治療が必要と判断され、かつ次の基準を満たす場合とされた。投与4 週以降~24 週まで:2 回の連続する規定来院時に EASI50 非達成、投与 24 週以降:来院時に EASI-50 非達成
7
は、治験薬との因果関係は否定されなかった。
中止に至った有害事象は、15 mg 投与例 7.9%(7/89 例)、30 mg 投与例 4.4%(4/90 例)に認められた。
副作用は、15 mg 投与例 44.9%(40/89 例)、30 mg 投与例 54.4%(49/90 例)に認められた。
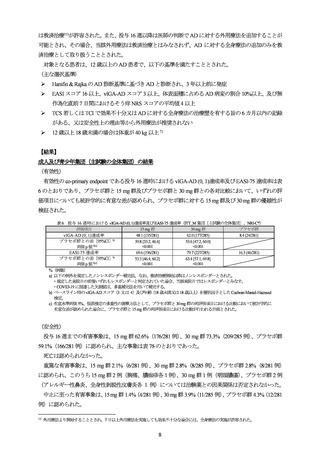
表 5 いずれかの用量で 3.0%以上に認められた有害事象
(投与 76 週まで、全ウパダシチニブ投与集団[主試験の 12 歳以上 18 歳未満の小児部分集団及び青少年副試験の全体集団の併合集団])
本剤 15 mg
本剤 30 mg
本剤 15 mg
本剤 30 mg
事象名
投与例
投与例
事象名
投与例
投与例
(89 例)
(90 例)
(89 例)
(90 例)
ざ瘡
23 (25.8)
28 (31.1)
鼻漏
3 (3.4)
2 (2.2)
ヘルペス性状湿疹
COVID-19
13 (14.6)
11 (12.2)
3 (3.4)
1 (1.1)
アトピー性皮膚炎
12 (13.5)
4 (4.4)
アラニンアミノトランスフェラーゼ増加
3 (3.4)
1 (1.1)
アスパラギン酸アミノトランスフェラー
上咽頭炎
11 (12.4)
13 (14.4)
3 (3.4)
1 (1.1)
ゼ増加
頭痛
血中尿酸増加
10 (11.2)
9 (10.0)
3 (3.4)
0
咳嗽
不規則月経
9 (10.1)
4 (4.4)
3 (3.4)
0
単純ヘルペス
8 (9.0)
3 (3.3)
湿疹
3 (3.4)
0
上気道感染
下痢
7 (7.9)
9 (10.0)
2 (2.2)
5 (5.6)
膿痂疹
ブドウ球菌皮膚感染
6 (6.7)
5 (5.6)
2 (2.2)
5 (5.6)
カタル
5 (5.6)
6 (6.7)
好中球数減少
2 (2.2)
5 (5.6)
血中クレアチンホスホキナーゼ増加
好中球減少症
4 (4.5)
16 (17.8)
2 (2.2)
4 (4.4)
嘔吐
4 (4.5)
7 (7.8)
伝染性軟属腫
2 (2.2)
4 (4.4)
腹痛
咽頭炎
4 (4.5)
6 (6.7)
2 (2.2)
4 (4.4)
悪心
白血球減少症
4 (4.5)
4 (4.4)
2 (2.2)
3 (3.3)
耳感染
4 (4.5)
1 (1.1)
上腹部痛
2 (2.2)
3 (3.3)
尿中蛋白陽性
インフルエンザ様疾患
4 (4.5)
1 (1.1)
2 (2.2)
3 (3.3)
喘息
胃腸炎
4 (4.5)
1 (1.1)
2 (2.2)
3 (3.3)
口腔咽頭痛
4 (4.5)
1 (1.1)
白血球数減少
1 (1.1)
6 (6.7)
そう痒症
ウイルス性上気道感染
4 (4.5)
1 (1.1)
1 (1.1)
4 (4.4)
貧血
4 (4.5)
0
膿疱性ざ瘡
1 (1.1)
3 (3.3)
発熱
帯状疱疹
3 (3.4)
7 (7.8)
1 (1.1)
3 (3.3)
尿路感染
レンサ球菌性咽頭炎
3 (3.4)
6 (6.7)
1 (1.1)
3 (3.3)
リンパ節症
3 (3.4)
3 (3.3)
扁桃炎
0
5 (5.6)
結膜炎
体重増加
3 (3.4)
2 (2.2)
0
4 (4.4)
毛包炎
例数(%)
3 (3.4)
2 (2.2)
国際共同第Ⅲ相試験(M16-045 試験 1))
:単独投与試験
【試験の概要】
TCS 若しくは TCI で効果不十分、AD に対する全身療法の治療歴がある、又は安全性上の理由等から外
用療法が推奨されない AD 患者(主試験:目標例数 810 例〔各群 270 例〕
、青少年副試験:12 歳以上 18 歳
未満の小児 AD 患者の目標例数 180 例 2)〔各群 60 例〕
)を対象に、プラセボに対する本剤の優越性及び安
全性を検討するため、プラセボ対照無作為化二重盲検並行群間比較試験が日本、米国、カナダ等の 24 の国
又は地域9)で実施された。
本試験は 2 期(二重盲検期:投与 16 週まで、継続投与期:投与 16 週以降 260 週まで)から構成され、
用法・用量は、二重盲検期では本剤 15 mg、30 mg 又はプラセボを、継続投与期では、二重盲検期に本剤が
投与された被験者は二重盲検期と同じ用量の本剤を、二重盲検期にプラセボが投与された被験者は本剤
15 mg 又は 30 mg をそれぞれ 1 日 1 回経口投与することと設定された。ベースライン時の 7 日以上前から
投与 16 週まで保湿外用薬を 1 日 2 回併用することとされ、投与 4 週以降に症状の改善が不十分な場合10)
9)
10)
このうち日本を含む 20 の国又は地域で 12 歳以上 18 歳未満の AD 患者が組み入れられた。
医師により救済治療が必要と判断され、かつ次の基準を満たす場合とされた。投与4 週以降~24 週まで:2 回の連続する規定来院時に EASI50 非達成、投与 24 週以降:来院時に EASI-50 非達成
7