よむ、つかう、まなぶ。
総-2参考3 (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_46580.html |
| 出典情報 | 中央社会保険医療協議会 総会(第599回 12/11)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
【結果】
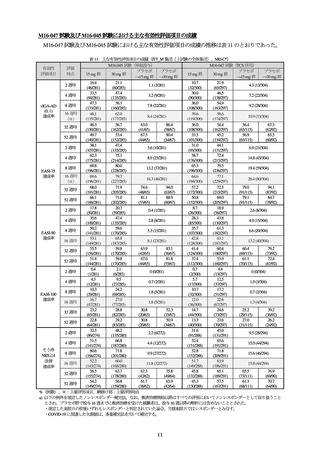
成人及び青少年集団(主試験の全体集団)の結果
(有効性)
有効性の co-primary endpoint である投与 16 週時における vIGA-AD (0, 1)達成率及び EASI-75 達成率は表
1 のとおりであり、プラセボ群と 15 mg 群及びプラセボ群と 30 mg 群との各対比較において、いずれの評
価項目についても統計学的に有意な差が認められ、プラセボ群に対する 15 mg 群及び 30 mg 群の優越性が
検証された。
表 1 投与 16 週時における vIGA-AD (0, 1)達成率及び EASI-75 達成率(ITT_M 集団[主試験の全体集団]、NRI-C a))
評価項目
15 mg 群
30 mg 群
プラセボ群
vIGA-AD (0, 1)達成率
39.6 (119/300)
58.6 (174/297)
10.9 (33/304)
プラセボ群との差[95%CI]b)
28.5 [22.1, 34.9]
47.6 [41.1, 54.0]
<0.001
<0.001
両側 p 値 b) c)
EASI-75 達成率
64.6 (194/300)
77.1 (229/297)
26.4 (80/304)
プラセボ群との差[95%CI]b)
38.1 [30.8, 45.4]
50.6 [43.8, 57.4]
<0.001
<0.001
両側 p 値 b) c)
%(例数)
a) 以下の例外を規定したノンレスポンダー補完法。なお、救済治療開始以降はノンレスポンダーとされた。
・規定した来院日の前後いずれもレスポンダーと判定されていた場合、当該来院日ではレスポンダーとみなす。
・COVID-19 に関連した欠測値は、多重補完法を用いて補完する。
b) ベースライン時の vIGA-AD スコア(3 又は 4)及び年齢(18 歳未満又は 18 歳以上)を層とした Cochran-Mantel-Haenszel 検定。
c) 有意水準両側 5%、仮説検定の多重性の調整方法として、プラセボ群と 30 mg 群の両評価項目における比較において統計学的に
有意な差が認められた場合に、プラセボ群と 15 mg 群の両評価項目における比較が行われる計画とされた。
(安全性)
投与 16 週までの有害事象は、15 mg 群 66.7%(200/300 例)
、30 mg 群 72.4%(215/297 例)
、プラセボ群
62.7%(190/303 例)に認められ、主な事象は表 2 のとおりであった。
死亡は認められなかった。
重篤な有害事象は、15 mg 群 2.3%(7/300 例)
、30 mg 群 1.3%(4/297 例)
、プラセボ群 3.0%(9/303 例)
に認められ、このうち 15 mg 群 4 例(網膜剥離、虫垂炎、過量投与、胸水各 1 例)
、プラセボ群 1 例(ブド
ウ球菌性敗血症)については治験薬との因果関係は否定されなかった。
中止に至った有害事象は、15 mg 群 1.3%(4/300 例)
、30 mg 群 1.3%(4/297 例)
、プラセボ群 2.3%(7/303
例)に認められた。
副作用は、15 mg 群 37.3%(112/300 例)
、30 mg 群 43.4%(129/297 例)
、プラセボ群 21.8%(66/303 例)
に認められた。
表 2 いずれかの群で 3.0%以上認められた有害事象(投与 16 週まで、安全性解析対象集団[主試験の全体集団])
15 mg 群 30 mg 群 プラセボ群
15 mg 群
30 mg 群 プラセボ群
事象名
事象名
(300 例) (297 例) (303 例)
(300 例) (297 例) (303 例)
上咽頭炎
37 (12.3)
40 (13.5)
34 (11.2)
インフルエンザ
11 (3.7)
7 (2.4)
2 (0.7)
ざ瘡
上腹部痛
30 (10.0)
41 (13.8)
6 (2.0)
11 (3.7)
3 (1.0)
1 (0.3)
上気道感染
アトピー性皮膚炎
21 (7.0)
23 (7.7)
22 (7.3)
11 (3.7)
2 (0.7)
20 (6.6)
頭痛
15 (5.0)
14 (4.7)
15 (5.0)
口腔ヘルペス
10 (3.3)
23 (7.7)
5 (1.7)
血中クレアチンホスホキナーゼ増加
毛包炎
13 (4.3)
18 (6.1)
7 (2.3)
8 (2.7)
11 (3.7)
3 (1.0)
咳嗽
13 (4.3)
11 (3.7)
4 (1.3)
口腔咽頭痛
6 (2.0)
9 (3.0)
3 (1.0)
下痢
11 (3.7)
12 (4.0)
7 (2.3)
尿路感染
5 (1.7)
11 (3.7)
6 (2.0)
例数(%)
最終被験者の投与 52 週時までの有害事象は、15 mg 投与例8) 80.4%(356/443 例)
、30 mg 投与例 8) 86.0%
8)
プラセボからの切換え例を含む。
5
成人及び青少年集団(主試験の全体集団)の結果
(有効性)
有効性の co-primary endpoint である投与 16 週時における vIGA-AD (0, 1)達成率及び EASI-75 達成率は表
1 のとおりであり、プラセボ群と 15 mg 群及びプラセボ群と 30 mg 群との各対比較において、いずれの評
価項目についても統計学的に有意な差が認められ、プラセボ群に対する 15 mg 群及び 30 mg 群の優越性が
検証された。
表 1 投与 16 週時における vIGA-AD (0, 1)達成率及び EASI-75 達成率(ITT_M 集団[主試験の全体集団]、NRI-C a))
評価項目
15 mg 群
30 mg 群
プラセボ群
vIGA-AD (0, 1)達成率
39.6 (119/300)
58.6 (174/297)
10.9 (33/304)
プラセボ群との差[95%CI]b)
28.5 [22.1, 34.9]
47.6 [41.1, 54.0]
<0.001
<0.001
両側 p 値 b) c)
EASI-75 達成率
64.6 (194/300)
77.1 (229/297)
26.4 (80/304)
プラセボ群との差[95%CI]b)
38.1 [30.8, 45.4]
50.6 [43.8, 57.4]
<0.001
<0.001
両側 p 値 b) c)
%(例数)
a) 以下の例外を規定したノンレスポンダー補完法。なお、救済治療開始以降はノンレスポンダーとされた。
・規定した来院日の前後いずれもレスポンダーと判定されていた場合、当該来院日ではレスポンダーとみなす。
・COVID-19 に関連した欠測値は、多重補完法を用いて補完する。
b) ベースライン時の vIGA-AD スコア(3 又は 4)及び年齢(18 歳未満又は 18 歳以上)を層とした Cochran-Mantel-Haenszel 検定。
c) 有意水準両側 5%、仮説検定の多重性の調整方法として、プラセボ群と 30 mg 群の両評価項目における比較において統計学的に
有意な差が認められた場合に、プラセボ群と 15 mg 群の両評価項目における比較が行われる計画とされた。
(安全性)
投与 16 週までの有害事象は、15 mg 群 66.7%(200/300 例)
、30 mg 群 72.4%(215/297 例)
、プラセボ群
62.7%(190/303 例)に認められ、主な事象は表 2 のとおりであった。
死亡は認められなかった。
重篤な有害事象は、15 mg 群 2.3%(7/300 例)
、30 mg 群 1.3%(4/297 例)
、プラセボ群 3.0%(9/303 例)
に認められ、このうち 15 mg 群 4 例(網膜剥離、虫垂炎、過量投与、胸水各 1 例)
、プラセボ群 1 例(ブド
ウ球菌性敗血症)については治験薬との因果関係は否定されなかった。
中止に至った有害事象は、15 mg 群 1.3%(4/300 例)
、30 mg 群 1.3%(4/297 例)
、プラセボ群 2.3%(7/303
例)に認められた。
副作用は、15 mg 群 37.3%(112/300 例)
、30 mg 群 43.4%(129/297 例)
、プラセボ群 21.8%(66/303 例)
に認められた。
表 2 いずれかの群で 3.0%以上認められた有害事象(投与 16 週まで、安全性解析対象集団[主試験の全体集団])
15 mg 群 30 mg 群 プラセボ群
15 mg 群
30 mg 群 プラセボ群
事象名
事象名
(300 例) (297 例) (303 例)
(300 例) (297 例) (303 例)
上咽頭炎
37 (12.3)
40 (13.5)
34 (11.2)
インフルエンザ
11 (3.7)
7 (2.4)
2 (0.7)
ざ瘡
上腹部痛
30 (10.0)
41 (13.8)
6 (2.0)
11 (3.7)
3 (1.0)
1 (0.3)
上気道感染
アトピー性皮膚炎
21 (7.0)
23 (7.7)
22 (7.3)
11 (3.7)
2 (0.7)
20 (6.6)
頭痛
15 (5.0)
14 (4.7)
15 (5.0)
口腔ヘルペス
10 (3.3)
23 (7.7)
5 (1.7)
血中クレアチンホスホキナーゼ増加
毛包炎
13 (4.3)
18 (6.1)
7 (2.3)
8 (2.7)
11 (3.7)
3 (1.0)
咳嗽
13 (4.3)
11 (3.7)
4 (1.3)
口腔咽頭痛
6 (2.0)
9 (3.0)
3 (1.0)
下痢
11 (3.7)
12 (4.0)
7 (2.3)
尿路感染
5 (1.7)
11 (3.7)
6 (2.0)
例数(%)
最終被験者の投与 52 週時までの有害事象は、15 mg 投与例8) 80.4%(356/443 例)
、30 mg 投与例 8) 86.0%
8)
プラセボからの切換え例を含む。
5