よむ、つかう、まなぶ。
【資料4】医薬局からの定期報告[910KB] (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_47693.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第18回 12/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
第 18 回
医薬品等行政評価・監視委員会
2024(令和6)年 12 月 23 日
資料4
医薬局からの定期報告
1
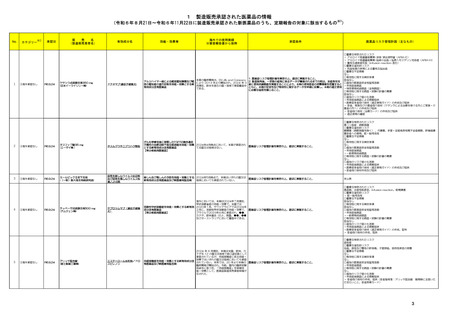
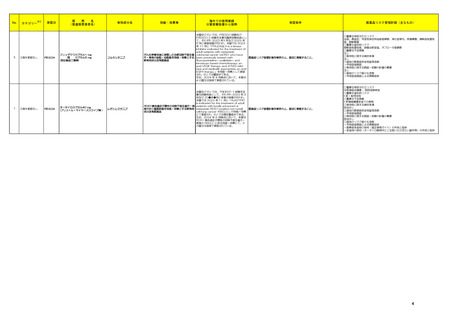
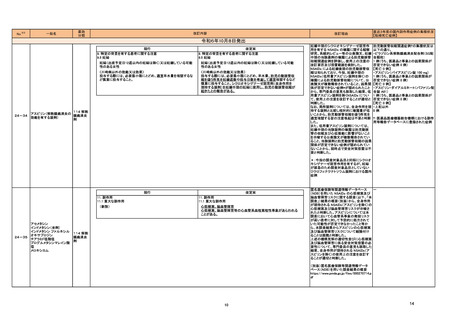
製造販売承認された医薬品の情報
3ページ
※1
本表は「「医薬局からの定期報告」の報告対象等について」(令和3年7月 19 日 医薬品
等行政評価・監視委員会決定、令和6年4月1日最終改訂)に基づき、新有効成分を含有する
医薬品のうち、以下のいずれかに該当するものを抜粋したもの。
①先駆け審査指定制度の対象品目
②条件付き早期承認制度の対象品目
③海外で承認されていない医薬品
④特例承認の対象品目
⑤緊急承認の対象品目
(海外での承認の有無及び使用実績は、審査報告書の記載により判断しています。)
※2
「カテゴリー」の語句は以下を指す。
①先駆(先駆け):先駆的医薬品指定制度(先駆け審査指定制度)の対象品目
②条件付き:条件付き早期承認制度の対象品目
③海外承認なし:海外で承認されていない医薬品
④特例承認:特例承認の対象品目
⑤緊急承認:緊急承認の対象品目
2
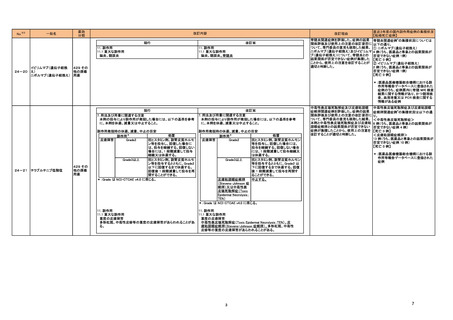
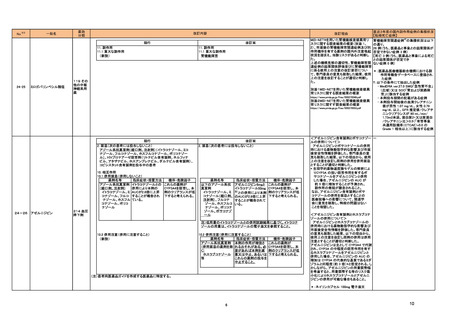
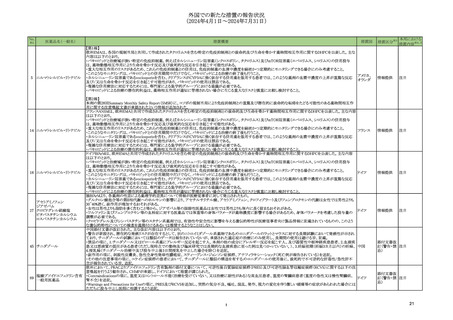
国内における市販後の安全対策の措置状況
5ページ
※1
本表は、令和6年 10 月 24 日に開催された令和6年度第2回薬事審議会医薬品等安全対策
部会に報告した内容について、「「医薬局からの定期報告」の報告対象等について」(令和3
年7月 19 日 医薬品等行政評価・監視委員会決定)に基づき必要な追記等を行ったもの。
※2
「No.」は安全対策部会の資料中で付与されている番号。
3
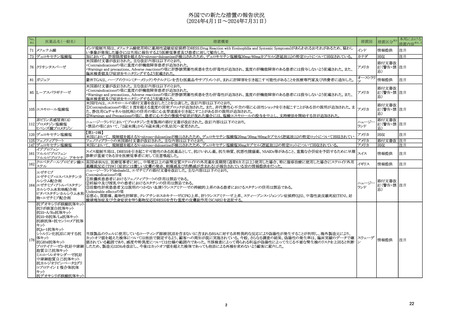
外国での新たな措置の報告状況
21 ページ
※1 本表は、令和6年 10 月 24 日に開催された令和6年度第2回薬事審議会医薬品等安全対策部
会に報告した内容について、「「医薬局からの定期報告」の報告対象等について」(令和3年
7月 19 日
医薬品等行政評価・監視委員会決定)に基づき抜粋したもの。
※2 「No.」は安全対策部会の資料中で付与されている番号。
1
医薬品等行政評価・監視委員会
2024(令和6)年 12 月 23 日
資料4
医薬局からの定期報告
1
製造販売承認された医薬品の情報
3ページ
※1
本表は「「医薬局からの定期報告」の報告対象等について」(令和3年7月 19 日 医薬品
等行政評価・監視委員会決定、令和6年4月1日最終改訂)に基づき、新有効成分を含有する
医薬品のうち、以下のいずれかに該当するものを抜粋したもの。
①先駆け審査指定制度の対象品目
②条件付き早期承認制度の対象品目
③海外で承認されていない医薬品
④特例承認の対象品目
⑤緊急承認の対象品目
(海外での承認の有無及び使用実績は、審査報告書の記載により判断しています。)
※2
「カテゴリー」の語句は以下を指す。
①先駆(先駆け):先駆的医薬品指定制度(先駆け審査指定制度)の対象品目
②条件付き:条件付き早期承認制度の対象品目
③海外承認なし:海外で承認されていない医薬品
④特例承認:特例承認の対象品目
⑤緊急承認:緊急承認の対象品目
2
国内における市販後の安全対策の措置状況
5ページ
※1
本表は、令和6年 10 月 24 日に開催された令和6年度第2回薬事審議会医薬品等安全対策
部会に報告した内容について、「「医薬局からの定期報告」の報告対象等について」(令和3
年7月 19 日 医薬品等行政評価・監視委員会決定)に基づき必要な追記等を行ったもの。
※2
「No.」は安全対策部会の資料中で付与されている番号。
3
外国での新たな措置の報告状況
21 ページ
※1 本表は、令和6年 10 月 24 日に開催された令和6年度第2回薬事審議会医薬品等安全対策部
会に報告した内容について、「「医薬局からの定期報告」の報告対象等について」(令和3年
7月 19 日
医薬品等行政評価・監視委員会決定)に基づき抜粋したもの。
※2 「No.」は安全対策部会の資料中で付与されている番号。
1