よむ、つかう、まなぶ。
【資料4】医薬局からの定期報告[910KB] (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_47693.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第18回 12/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
1
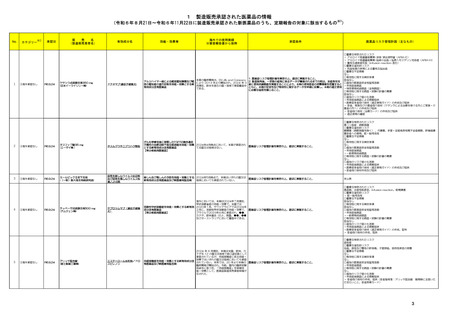
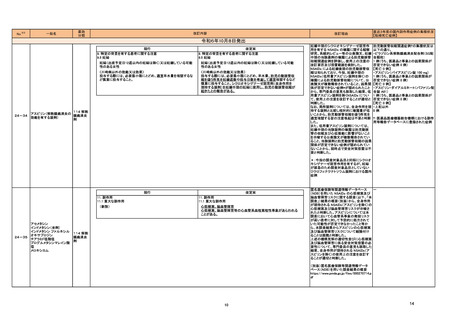
製造販売承認された医薬品の情報
(令和6年8月21日~令和6年11月22日に製造販売承認された新医薬品のうち、定期報告の対象に該当するもの※1)
No.
1
カテゴリー
※2
③海外承認なし
承認日
R6.9.24
販
売
名
(製造販売業者名)
ケサンラ点滴静注液350 mg
(日本イーライリリー㈱)
有効成分名
ドナネマブ(遺伝子組換え)
効能・効果等
海外での使用実績
※審査報告書から抜粋
承認条件
医薬品リスク管理計画(主なもの)
○重要な特定されたリスク
・ アミロイド関連画像異常-浮腫/滲出液貯留(ARIA-E)
・ アミロイド関連画像異常-脳微小出血・脳表ヘモジデリン沈着症(ARIA-H)
・ 重篤な過敏症反応(infusion reaction 含む)
○重要な潜在的リスク
・ 抗血栓薬の併用による重篤な脳出血
○重要な不足情報
なし
○有効性に関する検討事項
1. 医薬品リスク管理計画を策定の上、適切に実施すること。
本薬の臨床開発は、Eli Lilly and Company
該当なし
アルツハイマー病による軽度認知障害及び軽
2. 製造販売後、一定数の症例に係るデータが集積されるまでの間は、全症例を対
により 2013 年より開始され、2024 年 3
○追加の医薬品安全性監視活動
度の認知症の進行抑制を効能・効果とする新
象に使用成績調査を実施することにより、本剤の使用患者の背景情報を把握すると
月現在、欧米を含むの国・地域で承認審査中
・市販直後調査
有効成分含有医薬品
ともに、本剤の安全性及び有効性に関するデータを早期に収集し、本剤の適正使用
である。
・特定使用成績調査(全例調査)
に必要な措置を講じること。
○有効性に関する調査・試験の計画の概要
該当なし
○追加のリスク最小化活動
・市販直後調査による情報提供
・医療従事者向け資材(適正使用ガイド)の作成及び提供
・ 患者、家族及び介護者向け資材(ケサンラによる治療を受ける方とご家族・介
護者の方へ)の作成及び提供
・ 患者向け資材(治療カード)の作成及び提供
・ 適正使用の確認
2
③海外承認なし
R6.9.24
タスフィゴ錠35 mg
(エーザイ㈱ )
タスルグラチニブコハク酸塩
がん化学療法後に増悪したFGFR2融合遺伝
子陽性の治癒切除不能な胆道癌を効能・効果 2024年4月時点において、本薬が承認され
とする新有効成分含有医薬品
てる国又は地域はない。
【希少疾病用医薬品】
医薬品リスク管理計画を策定の上、適切に実施すること。
○重要な特定されたリスク
高リン血症 網膜剥離
○重要な潜在的リスク
眼障害(網膜剥離を除く) 、爪障害、手掌・足底発赤知覚不全症候群、肝機能障
害患者への使用、胚・胎児毒性
○重要な不足情報
なし
○有効性に関する検討事項
なし
○追加の医薬品安全性監視活動
・市販直後調査
・一般使用成績調査
○有効性に関する調査・試験の計画の概要
なし
○追加のリスク最小化活動
・市販直後調査による情報提供
・医療従事者向け資材(適正使用ガイド)の作成及び提供
・患者向け資材作成及び提供
3
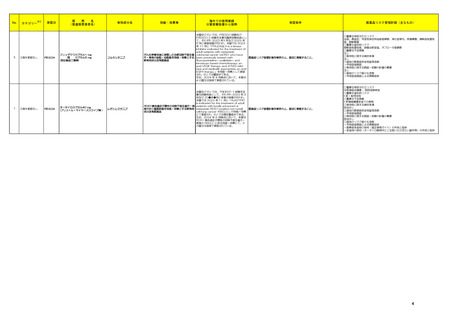
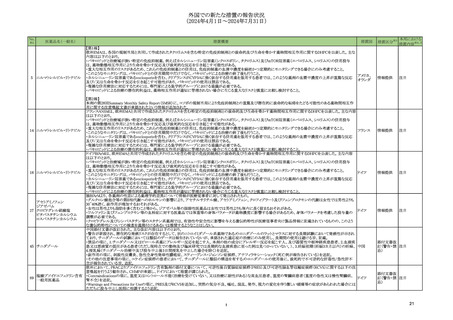
③海外承認なし
R6.9.24
ミールビックⅡ皮下注用
((一財)阪大微生物病研究会)
弱毒生麻しんウイルス田辺株
及び弱毒生風しんウイルス松
浦/J16株
麻しん及び風しんの予防を効能・効果とする 2024年5月時点で、本剤はいずれの国又は
新有効成分含有医薬品及び新医療用配合剤
地域においても承認されていない。
医薬品リスク管理計画を策定の上、適切に実施すること。
未公表
4
5
③海外承認なし
③海外承認なし
R6.9.24
R6.9.24
テッペーザ点滴静注用500 mg
(アムジェン㈱)
アリッサ配合錠
(富士製薬工業㈱)
テプロツムマブ(遺伝子組換
え)
エステトロール水和物/ドロ
スピレノン
海外においては、本剤は2024年7月現在、
甲状腺眼省症の効能・効果で、米国では
活動性甲状腺眼症を効能・効果とする新有効 2020年1月、サウジアラビアでは2024年
成分含有医薬品
2月に、活動性甲状腺眼症の効能・効果で、 医薬品リスク管理計画を策定の上、適切に実施すること。
【希少疾病用医薬品】
ブラジルで2023年6月に承認され、●●、
カナダ、欧州連合(EU)、英国、●●、●●
及びオーストラリアにおいて審査中である。
2024 年 6 月現在、本剤は米国、欧州、カ
ナダ等 12 の国又は地域で経口避妊薬として
承認されているが、月経困難症に係る効能・
効果ではいずれの国又は地域においても承認
月経困難症を効能・効果とする新有効成分含
されていない。本邦では、20 年より本剤の 医薬品リスク管理計画を策定の上、適切に実施すること。
有医薬品及び新医療用配合剤
臨床開発が開始され、今般、国内の臨床試験
成績等に基づき、「月経困難症」を申請効
能・効果として、医薬品製造販売承認申請が
なされた。
○重要な特定されたリスク
高血糖、炎症性腸疾患、Infusion reaction、聴覚障害
○重要な潜在的リスク
・ 胚・胎児毒性
○重要な不足情報
該当なし
○有効性に関する検討事項
該当なし
○追加の医薬品安全性監視活動
・市販直後調査
・一般使用成績調査
○有効性に関する調査・試験の計画の概要
該当なし
○追加のリスク最小化活動
・市販直後調査による情報提供
・医療従事者向け資材(適正使用ガイド)の作成、配布
・ 患者向け資材の作成、提供
○重要な特定されたリスク
血栓症
○重要な潜在的リスク
乳癌、良性及び悪性の肝腫瘍、子宮頸癌、器質性疾患の増悪
○重要な不足情報
なし
○有効性に関する検討事項
なし
○追加の医薬品安全性監視活動
・市販直後調査
○有効性に関する調査・試験の計画の概要
なし
○追加のリスク最小化活動
・市販直後調査による情報提供
・ 患者向け資材の作成、提供(患者指導箋:アリッサ配合錠
だきたいこと、患者携帯カード)
3
服用時に注意いた
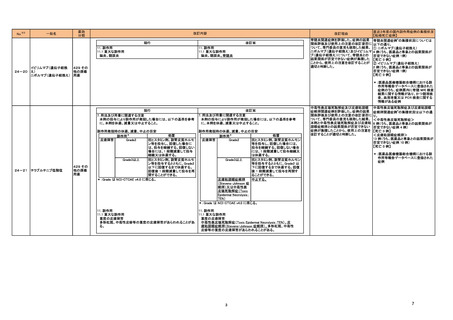
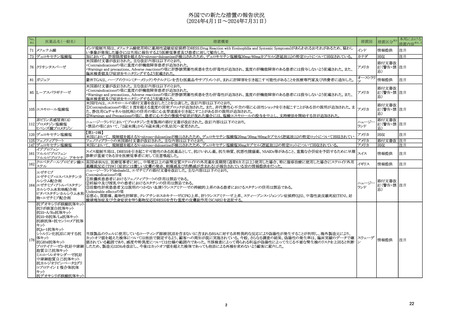
製造販売承認された医薬品の情報
(令和6年8月21日~令和6年11月22日に製造販売承認された新医薬品のうち、定期報告の対象に該当するもの※1)
No.
1
カテゴリー
※2
③海外承認なし
承認日
R6.9.24
販
売
名
(製造販売業者名)
ケサンラ点滴静注液350 mg
(日本イーライリリー㈱)
有効成分名
ドナネマブ(遺伝子組換え)
効能・効果等
海外での使用実績
※審査報告書から抜粋
承認条件
医薬品リスク管理計画(主なもの)
○重要な特定されたリスク
・ アミロイド関連画像異常-浮腫/滲出液貯留(ARIA-E)
・ アミロイド関連画像異常-脳微小出血・脳表ヘモジデリン沈着症(ARIA-H)
・ 重篤な過敏症反応(infusion reaction 含む)
○重要な潜在的リスク
・ 抗血栓薬の併用による重篤な脳出血
○重要な不足情報
なし
○有効性に関する検討事項
1. 医薬品リスク管理計画を策定の上、適切に実施すること。
本薬の臨床開発は、Eli Lilly and Company
該当なし
アルツハイマー病による軽度認知障害及び軽
2. 製造販売後、一定数の症例に係るデータが集積されるまでの間は、全症例を対
により 2013 年より開始され、2024 年 3
○追加の医薬品安全性監視活動
度の認知症の進行抑制を効能・効果とする新
象に使用成績調査を実施することにより、本剤の使用患者の背景情報を把握すると
月現在、欧米を含むの国・地域で承認審査中
・市販直後調査
有効成分含有医薬品
ともに、本剤の安全性及び有効性に関するデータを早期に収集し、本剤の適正使用
である。
・特定使用成績調査(全例調査)
に必要な措置を講じること。
○有効性に関する調査・試験の計画の概要
該当なし
○追加のリスク最小化活動
・市販直後調査による情報提供
・医療従事者向け資材(適正使用ガイド)の作成及び提供
・ 患者、家族及び介護者向け資材(ケサンラによる治療を受ける方とご家族・介
護者の方へ)の作成及び提供
・ 患者向け資材(治療カード)の作成及び提供
・ 適正使用の確認
2
③海外承認なし
R6.9.24
タスフィゴ錠35 mg
(エーザイ㈱ )
タスルグラチニブコハク酸塩
がん化学療法後に増悪したFGFR2融合遺伝
子陽性の治癒切除不能な胆道癌を効能・効果 2024年4月時点において、本薬が承認され
とする新有効成分含有医薬品
てる国又は地域はない。
【希少疾病用医薬品】
医薬品リスク管理計画を策定の上、適切に実施すること。
○重要な特定されたリスク
高リン血症 網膜剥離
○重要な潜在的リスク
眼障害(網膜剥離を除く) 、爪障害、手掌・足底発赤知覚不全症候群、肝機能障
害患者への使用、胚・胎児毒性
○重要な不足情報
なし
○有効性に関する検討事項
なし
○追加の医薬品安全性監視活動
・市販直後調査
・一般使用成績調査
○有効性に関する調査・試験の計画の概要
なし
○追加のリスク最小化活動
・市販直後調査による情報提供
・医療従事者向け資材(適正使用ガイド)の作成及び提供
・患者向け資材作成及び提供
3
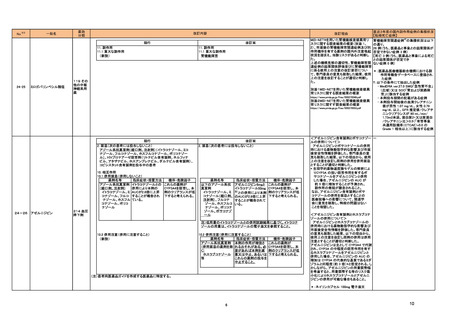
③海外承認なし
R6.9.24
ミールビックⅡ皮下注用
((一財)阪大微生物病研究会)
弱毒生麻しんウイルス田辺株
及び弱毒生風しんウイルス松
浦/J16株
麻しん及び風しんの予防を効能・効果とする 2024年5月時点で、本剤はいずれの国又は
新有効成分含有医薬品及び新医療用配合剤
地域においても承認されていない。
医薬品リスク管理計画を策定の上、適切に実施すること。
未公表
4
5
③海外承認なし
③海外承認なし
R6.9.24
R6.9.24
テッペーザ点滴静注用500 mg
(アムジェン㈱)
アリッサ配合錠
(富士製薬工業㈱)
テプロツムマブ(遺伝子組換
え)
エステトロール水和物/ドロ
スピレノン
海外においては、本剤は2024年7月現在、
甲状腺眼省症の効能・効果で、米国では
活動性甲状腺眼症を効能・効果とする新有効 2020年1月、サウジアラビアでは2024年
成分含有医薬品
2月に、活動性甲状腺眼症の効能・効果で、 医薬品リスク管理計画を策定の上、適切に実施すること。
【希少疾病用医薬品】
ブラジルで2023年6月に承認され、●●、
カナダ、欧州連合(EU)、英国、●●、●●
及びオーストラリアにおいて審査中である。
2024 年 6 月現在、本剤は米国、欧州、カ
ナダ等 12 の国又は地域で経口避妊薬として
承認されているが、月経困難症に係る効能・
効果ではいずれの国又は地域においても承認
月経困難症を効能・効果とする新有効成分含
されていない。本邦では、20 年より本剤の 医薬品リスク管理計画を策定の上、適切に実施すること。
有医薬品及び新医療用配合剤
臨床開発が開始され、今般、国内の臨床試験
成績等に基づき、「月経困難症」を申請効
能・効果として、医薬品製造販売承認申請が
なされた。
○重要な特定されたリスク
高血糖、炎症性腸疾患、Infusion reaction、聴覚障害
○重要な潜在的リスク
・ 胚・胎児毒性
○重要な不足情報
該当なし
○有効性に関する検討事項
該当なし
○追加の医薬品安全性監視活動
・市販直後調査
・一般使用成績調査
○有効性に関する調査・試験の計画の概要
該当なし
○追加のリスク最小化活動
・市販直後調査による情報提供
・医療従事者向け資材(適正使用ガイド)の作成、配布
・ 患者向け資材の作成、提供
○重要な特定されたリスク
血栓症
○重要な潜在的リスク
乳癌、良性及び悪性の肝腫瘍、子宮頸癌、器質性疾患の増悪
○重要な不足情報
なし
○有効性に関する検討事項
なし
○追加の医薬品安全性監視活動
・市販直後調査
○有効性に関する調査・試験の計画の概要
なし
○追加のリスク最小化活動
・市販直後調査による情報提供
・ 患者向け資材の作成、提供(患者指導箋:アリッサ配合錠
だきたいこと、患者携帯カード)
3
服用時に注意いた