よむ、つかう、まなぶ。
【資料4】医薬局からの定期報告[910KB] (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_47693.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第18回 12/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
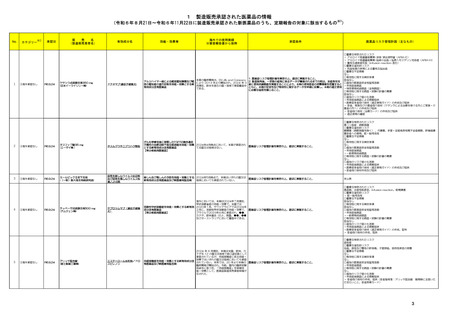
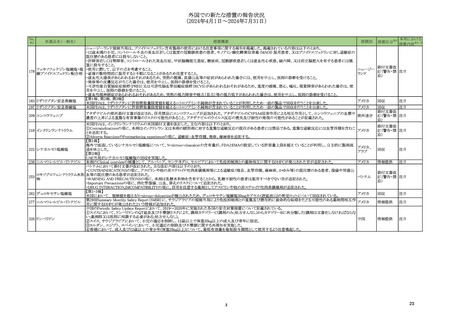
No.
6
7
カテゴリー
※2
③海外承認なし
③海外承認なし
承認日
R6.9.24
R6.9.24
販
売
名
(製造販売業者名)
フリュザクラカプセル1 mg
同
カプセル5 mg
(武田薬品工業㈱)
オータイロカプセル40 mg
(ブリストル・マイヤーズスクイブ㈱ )
有効成分名
効能・効果等
海外での使用実績
※審査報告書から抜粋
承認条件
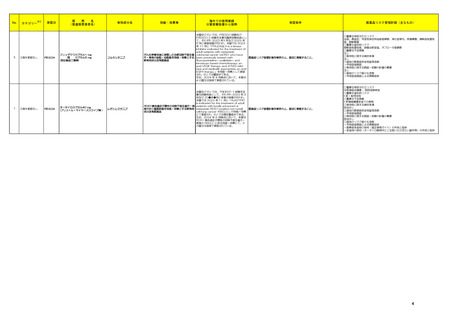
フルキンチニブ
米国及び EU では、FRESCO 試験及び
FRESCO-2 試験を主要な臨床試験成績とし
て、それぞれ 2023 年3 月及び 2023 年
5 月に承認申請が行われ、米国では 2023
年 11 月に「FRUZAQLA is a kinase
inhibitor indicated for the treatment of
adult patients with metastatic
がん化学療法後に増悪した治癒切除不能な進 colorectal cancer (mCRC) who have
行・再発の結腸・直腸癌を効能・効果とする been previously treated with
医薬品リスク管理計画を策定の上、適切に実施すること。
新有効成分含有医薬品
fluoropyrimidine-, oxaliplatin-, and
irinotecan-based chemotherapy, an
anti-VEGF therapy, and, if RAS wildtype and medically appropriate, an antiEGFR therapy.」を効能・効果として承認
され、EU では審査中である。
なお、2024 年 4 月時点において、本薬は
4 の国又は地域で承認されている。
レポトレクチニブ
米国及び EU では、TRIDENT-1 試験を主
要な試験成績として、それぞれ 2023 年 3
月及び 20●年●月に本薬の申請が行われ、
米国では 2023 年 11 月に「AUGTYRO
is indicated for the treatment of adult
ROS1 融合遺伝子陽性の切除不能な進行・再 patients with locally advanced or
発の非小細胞肺癌を効能・効果とする新有効 metastatic ROS1-positive non-small
医薬品リスク管理計画を策定の上、適切に実施すること。
成分含有医薬品
cell lung cancer (NSCLC)」の効能・効果
にて承認され、EU では現在審査中である。
なお、2024 年 6 月時点において、本薬は
ROS1 融合遺伝子陽性の切除不能な進行・
再発の NSCLC に係る効能・効果にて、3
の国又は地域で承認されている。
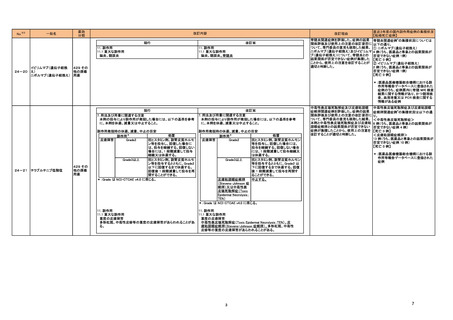
医薬品リスク管理計画(主なもの)
○重要な特定されたリスク
出血、高血圧、可逆性後白質脳症症候群、消化管穿孔、皮膚障害、静脈血栓塞栓
症、動脈解離
○重要な潜在的リスク
動脈血栓塞栓症、創傷治癒遅延、ネフローゼ症候群
○重要な不足情報
なし
○有効性に関する検討事項
なし
○追加の医薬品安全性監視活動
・市販直後調査
○有効性に関する調査・試験の計画の概要
なし
○追加のリスク最小化活動
・市販直後調査による情報提供
○重要な特定されたリスク
中枢神経系障害 、間質性肺疾患
○重要な潜在的リスク
胚・胎児毒性
○重要な不足情報
肝機能障害患者での使用
○有効性に関する検討事項
該当なし
○追加の医薬品安全性監視活動
・市販直後調査
○有効性に関する調査・試験の計画の概要
該当なし
○追加のリスク最小化活動
・市販直後調査による情報提供
・医療従事者向け資材(適正使用ガイド)の作成と提供
・患者向け資材(オータイロ服用中にご注意いただきたい副作用)の作成と提供
4
6
7
カテゴリー
※2
③海外承認なし
③海外承認なし
承認日
R6.9.24
R6.9.24
販
売
名
(製造販売業者名)
フリュザクラカプセル1 mg
同
カプセル5 mg
(武田薬品工業㈱)
オータイロカプセル40 mg
(ブリストル・マイヤーズスクイブ㈱ )
有効成分名
効能・効果等
海外での使用実績
※審査報告書から抜粋
承認条件
フルキンチニブ
米国及び EU では、FRESCO 試験及び
FRESCO-2 試験を主要な臨床試験成績とし
て、それぞれ 2023 年3 月及び 2023 年
5 月に承認申請が行われ、米国では 2023
年 11 月に「FRUZAQLA is a kinase
inhibitor indicated for the treatment of
adult patients with metastatic
がん化学療法後に増悪した治癒切除不能な進 colorectal cancer (mCRC) who have
行・再発の結腸・直腸癌を効能・効果とする been previously treated with
医薬品リスク管理計画を策定の上、適切に実施すること。
新有効成分含有医薬品
fluoropyrimidine-, oxaliplatin-, and
irinotecan-based chemotherapy, an
anti-VEGF therapy, and, if RAS wildtype and medically appropriate, an antiEGFR therapy.」を効能・効果として承認
され、EU では審査中である。
なお、2024 年 4 月時点において、本薬は
4 の国又は地域で承認されている。
レポトレクチニブ
米国及び EU では、TRIDENT-1 試験を主
要な試験成績として、それぞれ 2023 年 3
月及び 20●年●月に本薬の申請が行われ、
米国では 2023 年 11 月に「AUGTYRO
is indicated for the treatment of adult
ROS1 融合遺伝子陽性の切除不能な進行・再 patients with locally advanced or
発の非小細胞肺癌を効能・効果とする新有効 metastatic ROS1-positive non-small
医薬品リスク管理計画を策定の上、適切に実施すること。
成分含有医薬品
cell lung cancer (NSCLC)」の効能・効果
にて承認され、EU では現在審査中である。
なお、2024 年 6 月時点において、本薬は
ROS1 融合遺伝子陽性の切除不能な進行・
再発の NSCLC に係る効能・効果にて、3
の国又は地域で承認されている。
医薬品リスク管理計画(主なもの)
○重要な特定されたリスク
出血、高血圧、可逆性後白質脳症症候群、消化管穿孔、皮膚障害、静脈血栓塞栓
症、動脈解離
○重要な潜在的リスク
動脈血栓塞栓症、創傷治癒遅延、ネフローゼ症候群
○重要な不足情報
なし
○有効性に関する検討事項
なし
○追加の医薬品安全性監視活動
・市販直後調査
○有効性に関する調査・試験の計画の概要
なし
○追加のリスク最小化活動
・市販直後調査による情報提供
○重要な特定されたリスク
中枢神経系障害 、間質性肺疾患
○重要な潜在的リスク
胚・胎児毒性
○重要な不足情報
肝機能障害患者での使用
○有効性に関する検討事項
該当なし
○追加の医薬品安全性監視活動
・市販直後調査
○有効性に関する調査・試験の計画の概要
該当なし
○追加のリスク最小化活動
・市販直後調査による情報提供
・医療従事者向け資材(適正使用ガイド)の作成と提供
・患者向け資材(オータイロ服用中にご注意いただきたい副作用)の作成と提供
4