よむ、つかう、まなぶ。
【資料4】医薬局からの定期報告[910KB] (23 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_47693.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第18回 12/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
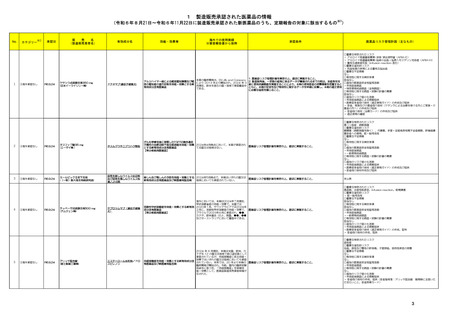
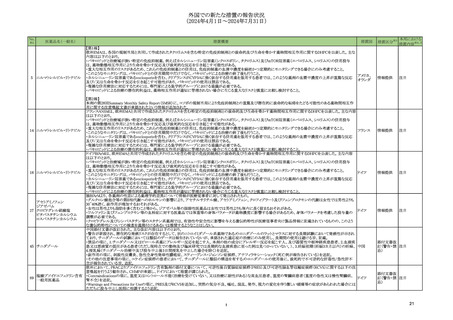
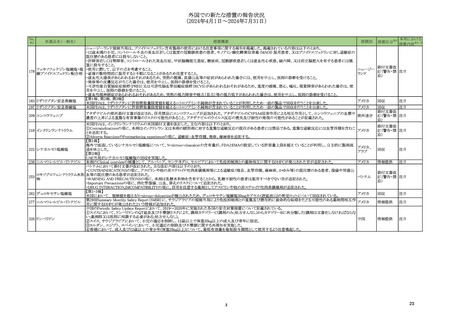
外国での新たな措置の報告状況
(2024年4月1日~2024年7月31日)
No.
※2
医薬品名(一般名)
措置概要
措置国
措置区分※3
本邦における
措置内容※4、5
ニュージーランド規制当局は、プソイドエフェドリン含有製剤の使用における注意事項に関する報告を掲載した。掲載されている内容は以下のとおり。
・12歳未満の小児、コントロール不良の高血圧若しくは重度の冠動脈疾患の患者、モノアミン酸化酵素阻害薬 (MAOI) 服用患者、又はプソイドエフェドリンに対し過敏症の
既往歴のある患者には投与しないこと。
・肝障害若しくは腎障害、コントロールされた高血圧症、甲状腺機能亢進症、糖尿病、冠動脈疾患若しくは虚血性心疾患、緑内障、又は前立腺肥大を有する患者には慎
重に投与すること。
添付文書改
フェキソフェナジン塩酸塩・塩 ・使用に際して、以下の点を考慮すること。
ニュージー
178
訂(警告・禁 注目
酸プソイドエフェドリン配合剤 -就寝の数時間前に服用すると不眠になることがあるため注意すること。
ランド
忌)
-虚血性大腸炎があらわれるおそれがあるため、突然の腹痛、直腸出血等の症状があらわれた場合には、使用を中止し、医師の診断を受けること。
-発疹等の皮膚反応が生じた場合は、使用を中止し、医師の診察を受けること。
-可逆性後白質脳症症候群(PRES)又は可逆性脳血管収縮症候群(RCVS)があらわれるおそれがあるため、重度の頭痛、悪心、嘔吐、視覚障害があらわれた場合は、使
用を中止し、医師の診察を受けること。
-虚血性視神経症があらわれるおそれがあるため、突然の視力障害や暗点(盲点)等の視力低下があらわれた場合は、使用を中止し、医師の診察を受けること。
【第1報、第2報、第3報】
183 リザトリプタン安息香酸塩
アメリカ
回収
注目
米国FDAは、リザトリプタンに許容摂取量限度値を超えるニトロソアミン不純物が含まれていることが判明したため一部の製品で回収を行うことを公表した。
197 リザトリプタン安息香酸塩
米国FDAは、リザトリプタンに許容摂取量限度値を超えるニトロソアミン不純物が含まれていることが判明したため一部の製品で回収を行うことを公表した。
アメリカ
回収
注目
添付文書改
アタザナビルの欧州添付文書が改訂され、併用禁忌にエンコラフェニブが追加された。アタザナビルのCYP3A4阻害作用による相互作用として、エンコラフェニブの血漿中
209 エンコラフェニブ
欧州連合 訂(警告・禁 注目
濃度の上昇による重篤な有害事象のリスクの可能性があること、アタザナビルのウイルス反応の喪失及び耐性の発現の可能性があることが記載された。
忌)
米国FDAは、インクリシランナトリウムの米国添付文書を改訂した。主な内容は以下のとおり。
添付文書改
①Contraindicationsの項に、本剤はインクリシラン又は本剤の賦形剤に対する重篤な過敏反応の既往がある患者には禁忌である。重篤な過敏反応には血管浮腫を含むこ
218 インクリシランナトリウム
アメリカ
訂(警告・禁 注目
とを追記する。
忌)
②Adverse ReactionsのPostmarketing experienceの項に、過敏症:血管浮腫、発疹、蕁麻疹を追記する。
【第1報】
海外で流通しているシナカルセト塩酸塩について、N-nitroso-cinacalcetの含有量が、FDAとEMAの設定している許容量上限を超えていることが判明し、自主的に製剤流
アメリカ、
222 シナカルセト塩酸塩
通を休止した。
回収
注目
アラブ
【第2報】
UAE当局がシナカルセト塩酸塩の回収を実施した。
238 ニルマトレルビル・リトナビル 本剤のClinical overviewの補遺として、アルバニア、モンテネグロ、セルビアにおいて免疫抑制剤との薬物相互に関するDHPCが発出された旨が追記された。
アメリカ
情報提供
注目
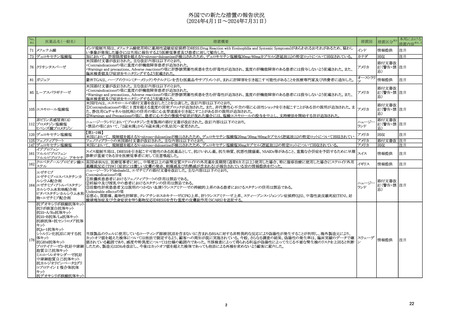
ベトナムにおいて添付文書が改訂された。主な改訂内容は以下のとおり。
・CONTRAINDICATIONSの項に、アスピリンや他の非ステロイド性消炎鎮痛剤等による過敏症(喘息、血管浮腫、蕁麻疹、かゆみ等)の既往歴のある患者、潰瘍や胃腸出
添付文書改
ロキソプロフェンナトリウム水和 血等の既往歴のある患者が追記された。
253
ベトナム
訂(警告・禁 注目
物
・WARNING AND PRECAUTIONSの項に、本剤は乳糖水和物を含有することから、乳糖不耐性の患者は服用すべきでない旨が追記された。
忌)
・Important Precautionsの項に、消化管潰瘍、出血、穿孔のリスクについて追記された。
・DRUG INTERACTION,IMCOMPATIBILITYの項に、併用を注意する薬剤としてアスピリンや他の非ステロイド性消炎鎮痛剤が追記された。
【第1-3報】
262 デュロキセチン塩酸塩
アメリカ
回収
注目
米国において、 規制値を超えるN-nitroso-duloxetineが検出されたため、デュロキセチン塩酸塩30mgカプセル(遅延放出)の特定ロットについて回収されている。
第29回Summary Monthly Safety Report(SMSR)に、サウジアラビアの規制当局により免疫抑制剤との重篤及び潜在的に致命的な転帰をたどる可能性のある薬物間相互作
277 ニルマトレルビル・リトナビル
アメリカ
情報提供
注目
用に関するDHPCが発出されたという情報が追加された。
中国のPeriodic Safety Update Reportにおいて、2019~2020年に実施された各国の安全対策措置について記載されている。
①スイスにおいて、ドンペリドンのQT延長及び不整脈リスクにより、調剤カテゴリーC(調剤のみ;処方せんなし)からカテゴリーBに再分類した(調剤は文書化しなければならな
い;薬剤師又は医師に相談する必要がある;処方せんなし)。
320 ドンペリドン
中国
情報提供
注目
②スイス、サウジアラビアにおいて、小児の適応を削除し、12歳以上で体重35kg以上の成人及び青年に限定。
③ヨルダン、エジプト、スペインにおいて、小児適応の削除及び不整脈に関する再周知を実施した。
④香港において、成人及び12歳以上の青少年(体重35kg以上)について、最低有効量を最短投与期間として使用するよう注意喚起した。
3
23
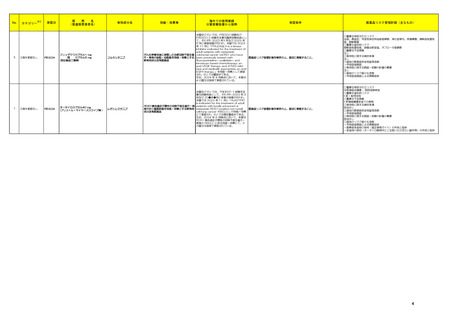
(2024年4月1日~2024年7月31日)
No.
※2
医薬品名(一般名)
措置概要
措置国
措置区分※3
本邦における
措置内容※4、5
ニュージーランド規制当局は、プソイドエフェドリン含有製剤の使用における注意事項に関する報告を掲載した。掲載されている内容は以下のとおり。
・12歳未満の小児、コントロール不良の高血圧若しくは重度の冠動脈疾患の患者、モノアミン酸化酵素阻害薬 (MAOI) 服用患者、又はプソイドエフェドリンに対し過敏症の
既往歴のある患者には投与しないこと。
・肝障害若しくは腎障害、コントロールされた高血圧症、甲状腺機能亢進症、糖尿病、冠動脈疾患若しくは虚血性心疾患、緑内障、又は前立腺肥大を有する患者には慎
重に投与すること。
添付文書改
フェキソフェナジン塩酸塩・塩 ・使用に際して、以下の点を考慮すること。
ニュージー
178
訂(警告・禁 注目
酸プソイドエフェドリン配合剤 -就寝の数時間前に服用すると不眠になることがあるため注意すること。
ランド
忌)
-虚血性大腸炎があらわれるおそれがあるため、突然の腹痛、直腸出血等の症状があらわれた場合には、使用を中止し、医師の診断を受けること。
-発疹等の皮膚反応が生じた場合は、使用を中止し、医師の診察を受けること。
-可逆性後白質脳症症候群(PRES)又は可逆性脳血管収縮症候群(RCVS)があらわれるおそれがあるため、重度の頭痛、悪心、嘔吐、視覚障害があらわれた場合は、使
用を中止し、医師の診察を受けること。
-虚血性視神経症があらわれるおそれがあるため、突然の視力障害や暗点(盲点)等の視力低下があらわれた場合は、使用を中止し、医師の診察を受けること。
【第1報、第2報、第3報】
183 リザトリプタン安息香酸塩
アメリカ
回収
注目
米国FDAは、リザトリプタンに許容摂取量限度値を超えるニトロソアミン不純物が含まれていることが判明したため一部の製品で回収を行うことを公表した。
197 リザトリプタン安息香酸塩
米国FDAは、リザトリプタンに許容摂取量限度値を超えるニトロソアミン不純物が含まれていることが判明したため一部の製品で回収を行うことを公表した。
アメリカ
回収
注目
添付文書改
アタザナビルの欧州添付文書が改訂され、併用禁忌にエンコラフェニブが追加された。アタザナビルのCYP3A4阻害作用による相互作用として、エンコラフェニブの血漿中
209 エンコラフェニブ
欧州連合 訂(警告・禁 注目
濃度の上昇による重篤な有害事象のリスクの可能性があること、アタザナビルのウイルス反応の喪失及び耐性の発現の可能性があることが記載された。
忌)
米国FDAは、インクリシランナトリウムの米国添付文書を改訂した。主な内容は以下のとおり。
添付文書改
①Contraindicationsの項に、本剤はインクリシラン又は本剤の賦形剤に対する重篤な過敏反応の既往がある患者には禁忌である。重篤な過敏反応には血管浮腫を含むこ
218 インクリシランナトリウム
アメリカ
訂(警告・禁 注目
とを追記する。
忌)
②Adverse ReactionsのPostmarketing experienceの項に、過敏症:血管浮腫、発疹、蕁麻疹を追記する。
【第1報】
海外で流通しているシナカルセト塩酸塩について、N-nitroso-cinacalcetの含有量が、FDAとEMAの設定している許容量上限を超えていることが判明し、自主的に製剤流
アメリカ、
222 シナカルセト塩酸塩
通を休止した。
回収
注目
アラブ
【第2報】
UAE当局がシナカルセト塩酸塩の回収を実施した。
238 ニルマトレルビル・リトナビル 本剤のClinical overviewの補遺として、アルバニア、モンテネグロ、セルビアにおいて免疫抑制剤との薬物相互に関するDHPCが発出された旨が追記された。
アメリカ
情報提供
注目
ベトナムにおいて添付文書が改訂された。主な改訂内容は以下のとおり。
・CONTRAINDICATIONSの項に、アスピリンや他の非ステロイド性消炎鎮痛剤等による過敏症(喘息、血管浮腫、蕁麻疹、かゆみ等)の既往歴のある患者、潰瘍や胃腸出
添付文書改
ロキソプロフェンナトリウム水和 血等の既往歴のある患者が追記された。
253
ベトナム
訂(警告・禁 注目
物
・WARNING AND PRECAUTIONSの項に、本剤は乳糖水和物を含有することから、乳糖不耐性の患者は服用すべきでない旨が追記された。
忌)
・Important Precautionsの項に、消化管潰瘍、出血、穿孔のリスクについて追記された。
・DRUG INTERACTION,IMCOMPATIBILITYの項に、併用を注意する薬剤としてアスピリンや他の非ステロイド性消炎鎮痛剤が追記された。
【第1-3報】
262 デュロキセチン塩酸塩
アメリカ
回収
注目
米国において、 規制値を超えるN-nitroso-duloxetineが検出されたため、デュロキセチン塩酸塩30mgカプセル(遅延放出)の特定ロットについて回収されている。
第29回Summary Monthly Safety Report(SMSR)に、サウジアラビアの規制当局により免疫抑制剤との重篤及び潜在的に致命的な転帰をたどる可能性のある薬物間相互作
277 ニルマトレルビル・リトナビル
アメリカ
情報提供
注目
用に関するDHPCが発出されたという情報が追加された。
中国のPeriodic Safety Update Reportにおいて、2019~2020年に実施された各国の安全対策措置について記載されている。
①スイスにおいて、ドンペリドンのQT延長及び不整脈リスクにより、調剤カテゴリーC(調剤のみ;処方せんなし)からカテゴリーBに再分類した(調剤は文書化しなければならな
い;薬剤師又は医師に相談する必要がある;処方せんなし)。
320 ドンペリドン
中国
情報提供
注目
②スイス、サウジアラビアにおいて、小児の適応を削除し、12歳以上で体重35kg以上の成人及び青年に限定。
③ヨルダン、エジプト、スペインにおいて、小児適応の削除及び不整脈に関する再周知を実施した。
④香港において、成人及び12歳以上の青少年(体重35kg以上)について、最低有効量を最短投与期間として使用するよう注意喚起した。
3
23