よむ、つかう、まなぶ。
【資料4】医薬局からの定期報告[910KB] (22 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_47693.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第18回 12/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
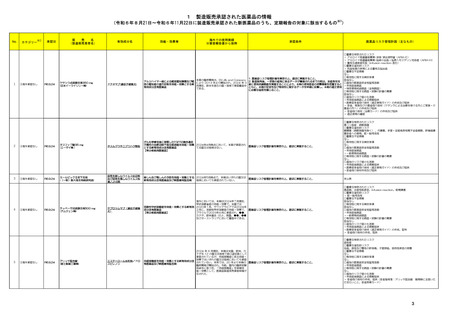
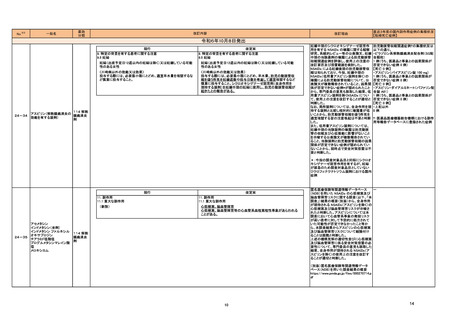
外国での新たな措置の報告状況
(2024年4月1日~2024年7月31日)
No.
※2
医薬品名(一般名)
71 メフェナム酸
73 デュロキセチン塩酸塩
76 クリサンタスパーゼ
81 ガジュツ
85 L-アスパラギナーゼ
105 エスモロール塩酸塩
非ピリン系感冒剤(4)
112 プロメタジン塩酸塩
ヒベンズ酸プロメタジン
120 デュロキセチン塩酸塩
措置概要
インド規制当局は、メフェナム酸使用時に薬剤性過敏症症候群(DRESS:Drug Reaction with Eosinophilia and Systemic Symptoms)があらわれるおそれがあるため、疑わし
い事象が発現した場合には当局に報告するよう医療従事者及び患者に対して勧告した。
加において、 許容限度値を超えるN-nitroso-duloxetineが検出されたため、デュロキセチン塩酸塩30mg/60mgカプセル(遅延放出)の特定ロットについて回収されている。
米国添付文書が改訂された。主な改訂内容は以下のとおり。
・Contraindicationsの項に重度の肝機能障害患者が追加された。
・Warnings and precautions、Adverse reactionsの項に肝静脈閉塞性疾患を含む肝毒性が追加され、重度の肝機能障害のある患者には投与しないよう記載された。また、
臨床検査値及び症状をモニタリングするよう記載された。
豪州TGAは、ハーブのウコン(ターメリック)やクルクミンを含む医薬品やサプリメントが、まれに肝障害を引き起こす可能性があることを医療専門家及び消費者に通知した。
措置区分※3
本邦における
措置内容※4、5
インド
情報提供
注目
カナダ
回収
注目
アメリカ
添付文書改
訂(警告・禁 注目
忌)
措置国
オーストラリ
情報提供
ア
米国添付文書が改訂された。主な改訂内容は以下のとおり。
・Contraindicationsの項に重度の肝機能障害患者が追加された。
アメリカ
・Warnings and precautions、Adverse reactionsの項に肝静脈閉塞性疾患を含む肝毒性が追加され、重度の肝機能障害のある患者には投与しないよう記載された。また、
臨床検査値及び症状をモニタリングするよう記載された。
米国FDAは、エスモロールの添付文書を改訂したことを公表した。改訂内容は以下のとおり。
①Contraindicationsの項にⅠ度を超える重度の房室ブロックが追加された。また、非代償性心不全の項に心原性ショックを引き起こすことがある旨の説明が追加された。ま
アメリカ
た、静注用Caチャネル拮抗剤との併用の項に心血管虚脱を引き起こすことがある旨の説明が追加された。
②Warnings and Precautionsの項に、患者に心不全の徴候や症状が現れた場合には、塩酸エスモロールの投与を中止し、支持療法を開始する旨が追加された。
ニュージーランドにおいてプロメタジン含有製剤の添付文書が改訂された。改訂内容は以下のとおり。
・禁忌の項において、「2歳未満」から「6歳未満」の乳幼児へ変更された。
注目
添付文書改
訂(警告・禁 注目
忌)
添付文書改
訂(警告・禁 注目
忌)
添付文書改
ニュージー
訂(警告・禁 注目
ランド
忌)
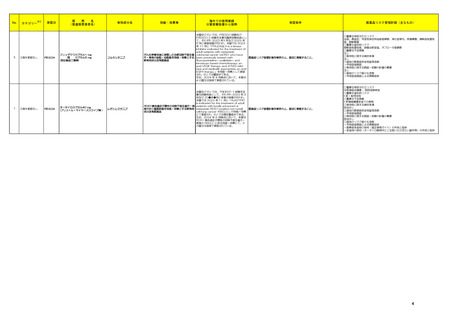
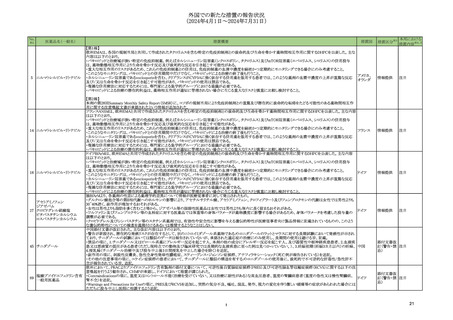
【第1-2報】
アメリカ
米国において、 規制値を超えるN-nitroso-duloxetineが検出されたため、デュロキセチン塩酸塩20mg/30mg/60mgカプセル(遅延放出)の特定ロットについて回収されてい
フェノフィブラートの米国添付文書が改訂された。主な内容は以下のとおり。
アメリカ
米国において、 規制値を超えるN-nitroso-duloxetineが検出されたため、デュロキセチン塩酸塩30mgカプセル(遅延放出)の特定ロットについて回収されている。
アメリカ
回収
注目
125 フェノフィブラート
添付文書改 注目
147 デュロキセチン塩酸塩
回収
注目
イブプロフェン
スイス規制当局は、DRESSを引き起こす可能性のある医薬品として、抗けいれん薬、抗生物質、抗悪性腫瘍薬、NSAIDs等があること、重篤な合併症を予防するために早期
161 フルルビプロフェン
スイス
情報提供
注目
診断が重要である旨を医療従事者に対して注意喚起した。
フルルビプロフェン アキセチ
クロベタゾールプロピオン酸エ 英国MHRAは、医療従事者に対し、中等度以上の副腎皮質ステロイドの外用薬を長期間(通常6カ月以上)使用した場合、特に湿疹治療に使用した場合にステロイド外用
162
イギリス
情報提供
注目
ステル
薬離脱反応(TSW)(症状には激しい皮膚の発赤、刺痛感及び灼熱感が含まれる)が報告されている旨の情報提供を行った。
ニュージーランドMedsafeは、エゼチミブの添付文書を改訂した。主な内容は以下のとおり。
エゼチミブ
Contraindicationsの項
エゼチミブ・ロスバスタチンカ
①胆嚢疾患患者におけるフェノフィブラートの併用は禁忌である。
ルシウム配合剤
添付文書改
ニュージー
②妊娠中及び授乳中の患者におけるスタチンの併用は禁忌である。
164 エゼチミブ・アトルバスタチン
訂(警告・禁 注目
ランド
③活動性肝疾患患者又は説明のつかない血清トランスアミナーゼの持続的上昇のある患者におけるスタチンの併用は禁忌である。
カルシウム水和物配合剤
忌)
Undesirable effectsの項
ピタバスタチンカルシウム水和
④悪心、関節痛、薬物性肝障害、クレアチンホスホキナーゼ(CPK)上昇、肝トランスアミナーゼ上昇、スティーブンス・ジョンソン症候群(SJS)、中毒性表皮壊死症(TEN)、好
物・エゼチミブ配合剤
酸球増加症及び全身症状を伴う薬物反応(DRESS)を含む重度の皮膚副作用(SCARS)を追記する。
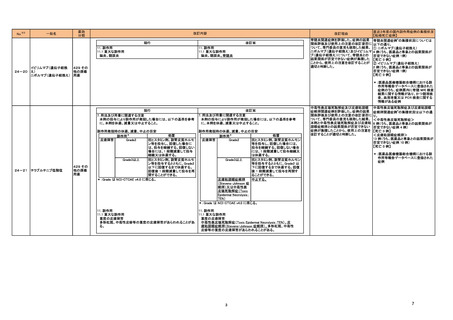
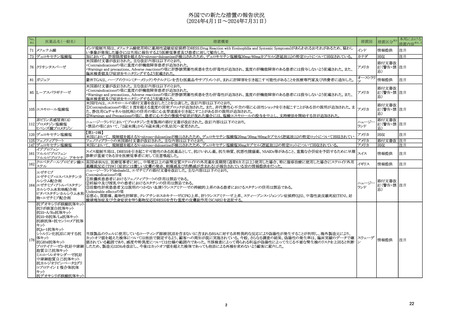
抗デオキシリボ核酸抗体キット
抗リボ核蛋白抗体キット
抗SS-A/Ro抗体キット
抗SS-B抗体/La抗体キット
抗核抗体・抗セントロメア抗体
キット
抗Jo-1抗体キット
シトルリン化抗原に対する抗 当該製品のウェルに使用しているコーティング溶液(抗原を含まない)に含まれるBSAに対する非特異的な反応により偽陽性が発生することが判明し、海外製造元により、
体キット
カットオフ値を超えた検体については他法で測定するよう、顧客への周知が既に実施されている。今般、さらなる調査の結果、偽陽性の発生率は、臨床実績のデータで確 スウェーデ
176
情報提供
注目
抗GBM抗体キット
認されている範囲であり、感度や特異度については仕様の範囲内であった。当該検査によって得られる利益が偽陽性によって生じる不要な腎生検のリスクを上回ると判断 ン
プロテイナーゼ3-抗好中球細 したため、製造元はDfuを改訂し、今後はカットオフ値を超えた検体であっても他法による再検を求めないよう顧客に案内した。
胞質自己抗体キット
ミエロペルオキシダーゼ抗好
中球細胞質自己抗体キット
抗カルジオリピンベータ2グリ
コプロテインⅠ複合体抗体
キット
抗デオキシリボ核酸抗体キット
2
22
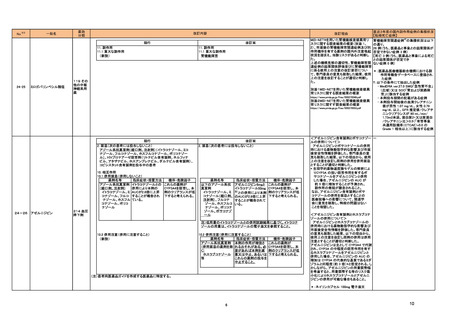
(2024年4月1日~2024年7月31日)
No.
※2
医薬品名(一般名)
71 メフェナム酸
73 デュロキセチン塩酸塩
76 クリサンタスパーゼ
81 ガジュツ
85 L-アスパラギナーゼ
105 エスモロール塩酸塩
非ピリン系感冒剤(4)
112 プロメタジン塩酸塩
ヒベンズ酸プロメタジン
120 デュロキセチン塩酸塩
措置概要
インド規制当局は、メフェナム酸使用時に薬剤性過敏症症候群(DRESS:Drug Reaction with Eosinophilia and Systemic Symptoms)があらわれるおそれがあるため、疑わし
い事象が発現した場合には当局に報告するよう医療従事者及び患者に対して勧告した。
加において、 許容限度値を超えるN-nitroso-duloxetineが検出されたため、デュロキセチン塩酸塩30mg/60mgカプセル(遅延放出)の特定ロットについて回収されている。
米国添付文書が改訂された。主な改訂内容は以下のとおり。
・Contraindicationsの項に重度の肝機能障害患者が追加された。
・Warnings and precautions、Adverse reactionsの項に肝静脈閉塞性疾患を含む肝毒性が追加され、重度の肝機能障害のある患者には投与しないよう記載された。また、
臨床検査値及び症状をモニタリングするよう記載された。
豪州TGAは、ハーブのウコン(ターメリック)やクルクミンを含む医薬品やサプリメントが、まれに肝障害を引き起こす可能性があることを医療専門家及び消費者に通知した。
措置区分※3
本邦における
措置内容※4、5
インド
情報提供
注目
カナダ
回収
注目
アメリカ
添付文書改
訂(警告・禁 注目
忌)
措置国
オーストラリ
情報提供
ア
米国添付文書が改訂された。主な改訂内容は以下のとおり。
・Contraindicationsの項に重度の肝機能障害患者が追加された。
アメリカ
・Warnings and precautions、Adverse reactionsの項に肝静脈閉塞性疾患を含む肝毒性が追加され、重度の肝機能障害のある患者には投与しないよう記載された。また、
臨床検査値及び症状をモニタリングするよう記載された。
米国FDAは、エスモロールの添付文書を改訂したことを公表した。改訂内容は以下のとおり。
①Contraindicationsの項にⅠ度を超える重度の房室ブロックが追加された。また、非代償性心不全の項に心原性ショックを引き起こすことがある旨の説明が追加された。ま
アメリカ
た、静注用Caチャネル拮抗剤との併用の項に心血管虚脱を引き起こすことがある旨の説明が追加された。
②Warnings and Precautionsの項に、患者に心不全の徴候や症状が現れた場合には、塩酸エスモロールの投与を中止し、支持療法を開始する旨が追加された。
ニュージーランドにおいてプロメタジン含有製剤の添付文書が改訂された。改訂内容は以下のとおり。
・禁忌の項において、「2歳未満」から「6歳未満」の乳幼児へ変更された。
注目
添付文書改
訂(警告・禁 注目
忌)
添付文書改
訂(警告・禁 注目
忌)
添付文書改
ニュージー
訂(警告・禁 注目
ランド
忌)
【第1-2報】
アメリカ
米国において、 規制値を超えるN-nitroso-duloxetineが検出されたため、デュロキセチン塩酸塩20mg/30mg/60mgカプセル(遅延放出)の特定ロットについて回収されてい
フェノフィブラートの米国添付文書が改訂された。主な内容は以下のとおり。
アメリカ
米国において、 規制値を超えるN-nitroso-duloxetineが検出されたため、デュロキセチン塩酸塩30mgカプセル(遅延放出)の特定ロットについて回収されている。
アメリカ
回収
注目
125 フェノフィブラート
添付文書改 注目
147 デュロキセチン塩酸塩
回収
注目
イブプロフェン
スイス規制当局は、DRESSを引き起こす可能性のある医薬品として、抗けいれん薬、抗生物質、抗悪性腫瘍薬、NSAIDs等があること、重篤な合併症を予防するために早期
161 フルルビプロフェン
スイス
情報提供
注目
診断が重要である旨を医療従事者に対して注意喚起した。
フルルビプロフェン アキセチ
クロベタゾールプロピオン酸エ 英国MHRAは、医療従事者に対し、中等度以上の副腎皮質ステロイドの外用薬を長期間(通常6カ月以上)使用した場合、特に湿疹治療に使用した場合にステロイド外用
162
イギリス
情報提供
注目
ステル
薬離脱反応(TSW)(症状には激しい皮膚の発赤、刺痛感及び灼熱感が含まれる)が報告されている旨の情報提供を行った。
ニュージーランドMedsafeは、エゼチミブの添付文書を改訂した。主な内容は以下のとおり。
エゼチミブ
Contraindicationsの項
エゼチミブ・ロスバスタチンカ
①胆嚢疾患患者におけるフェノフィブラートの併用は禁忌である。
ルシウム配合剤
添付文書改
ニュージー
②妊娠中及び授乳中の患者におけるスタチンの併用は禁忌である。
164 エゼチミブ・アトルバスタチン
訂(警告・禁 注目
ランド
③活動性肝疾患患者又は説明のつかない血清トランスアミナーゼの持続的上昇のある患者におけるスタチンの併用は禁忌である。
カルシウム水和物配合剤
忌)
Undesirable effectsの項
ピタバスタチンカルシウム水和
④悪心、関節痛、薬物性肝障害、クレアチンホスホキナーゼ(CPK)上昇、肝トランスアミナーゼ上昇、スティーブンス・ジョンソン症候群(SJS)、中毒性表皮壊死症(TEN)、好
物・エゼチミブ配合剤
酸球増加症及び全身症状を伴う薬物反応(DRESS)を含む重度の皮膚副作用(SCARS)を追記する。
抗デオキシリボ核酸抗体キット
抗リボ核蛋白抗体キット
抗SS-A/Ro抗体キット
抗SS-B抗体/La抗体キット
抗核抗体・抗セントロメア抗体
キット
抗Jo-1抗体キット
シトルリン化抗原に対する抗 当該製品のウェルに使用しているコーティング溶液(抗原を含まない)に含まれるBSAに対する非特異的な反応により偽陽性が発生することが判明し、海外製造元により、
体キット
カットオフ値を超えた検体については他法で測定するよう、顧客への周知が既に実施されている。今般、さらなる調査の結果、偽陽性の発生率は、臨床実績のデータで確 スウェーデ
176
情報提供
注目
抗GBM抗体キット
認されている範囲であり、感度や特異度については仕様の範囲内であった。当該検査によって得られる利益が偽陽性によって生じる不要な腎生検のリスクを上回ると判断 ン
プロテイナーゼ3-抗好中球細 したため、製造元はDfuを改訂し、今後はカットオフ値を超えた検体であっても他法による再検を求めないよう顧客に案内した。
胞質自己抗体キット
ミエロペルオキシダーゼ抗好
中球細胞質自己抗体キット
抗カルジオリピンベータ2グリ
コプロテインⅠ複合体抗体
キット
抗デオキシリボ核酸抗体キット
2
22