よむ、つかう、まなぶ。
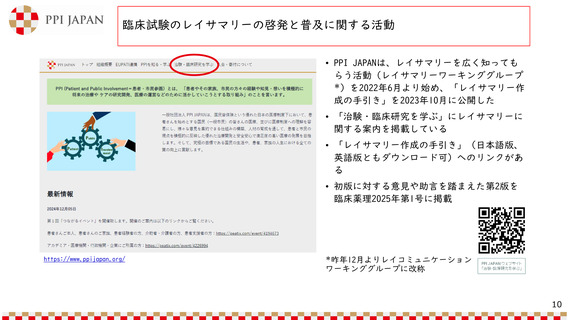
資料1-1:一般社団法人ピー・ピー・アイ・ジャパン 八木参考人 提出資料 (16 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_52767.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第40回 2/26)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
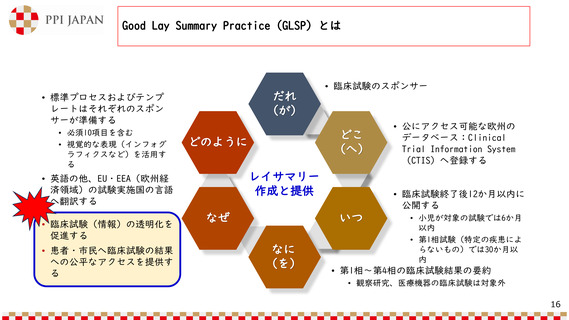
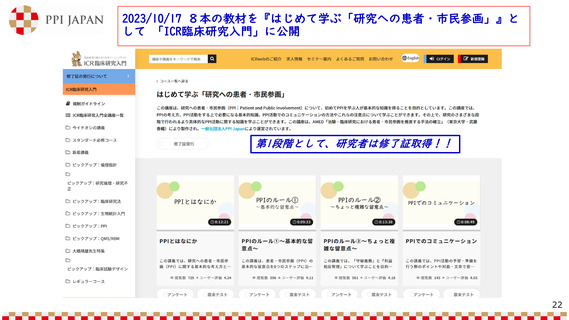
Good Lay Summary Practice(GLSP)とは
だれ
(が)
• 標準プロセスおよびテンプ
レートはそれぞれのスポン
サーが準備する
• 必須10項目を含む
• 視覚的な表現(インフォグ
ラフィクスなど)を活用す
る
• 患者・市民へ臨床試験の結果
への公平なアクセスを提供す
る
どこ
(へ)
どのように
レイサマリー
作成と提供
• 英語の他、EU・EEA(欧州経
済領域)の試験実施国の言語
へ翻訳する
• 臨床試験(情報)の透明化を
促進する
• 臨床試験のスポンサー
• 臨床試験終了後12か月以内に
公開する
いつ
なぜ
なに
(を)
• 公にアクセス可能な欧州の
データベース:Clinical
Trial Information System
(CTIS)へ登録する
• 小児が対象の試験では6か月
以内
• 第1相試験(特定の疾患によ
らないもの)では30か月以
内
• 第1相~第4相の臨床試験結果の要約
• 観察研究、医療機器の臨床試験は対象外
16
だれ
(が)
• 標準プロセスおよびテンプ
レートはそれぞれのスポン
サーが準備する
• 必須10項目を含む
• 視覚的な表現(インフォグ
ラフィクスなど)を活用す
る
• 患者・市民へ臨床試験の結果
への公平なアクセスを提供す
る
どこ
(へ)
どのように
レイサマリー
作成と提供
• 英語の他、EU・EEA(欧州経
済領域)の試験実施国の言語
へ翻訳する
• 臨床試験(情報)の透明化を
促進する
• 臨床試験のスポンサー
• 臨床試験終了後12か月以内に
公開する
いつ
なぜ
なに
(を)
• 公にアクセス可能な欧州の
データベース:Clinical
Trial Information System
(CTIS)へ登録する
• 小児が対象の試験では6か月
以内
• 第1相試験(特定の疾患によ
らないもの)では30か月以
内
• 第1相~第4相の臨床試験結果の要約
• 観察研究、医療機器の臨床試験は対象外
16