よむ、つかう、まなぶ。
資料1-1:一般社団法人ピー・ピー・アイ・ジャパン 八木参考人 提出資料 (18 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_52767.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第40回 2/26)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
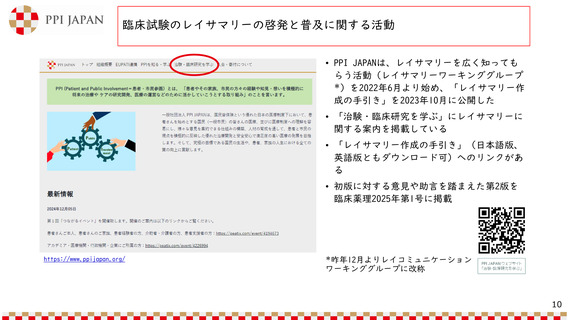
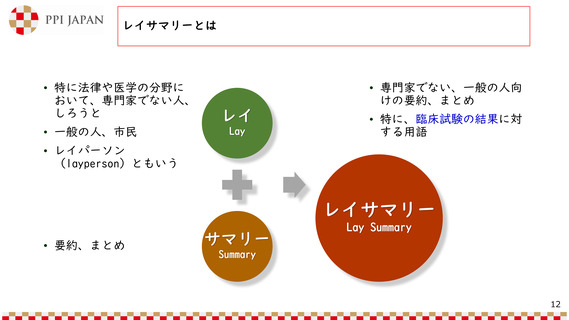
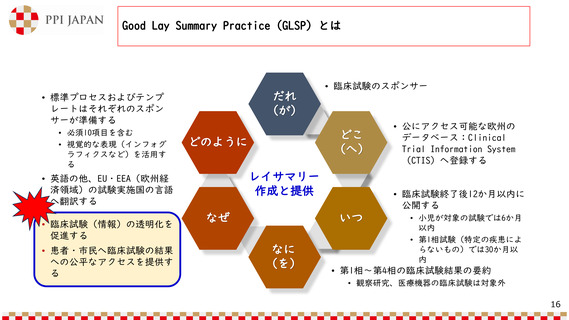
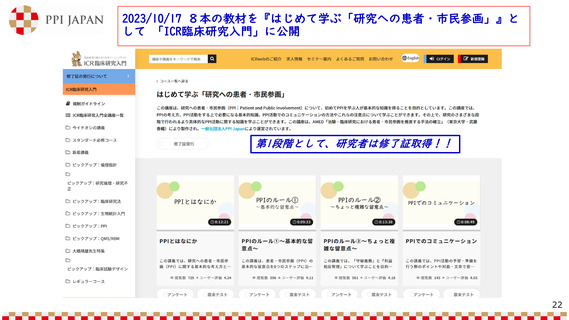
本邦における治験に係る情報の公開の現状
• 患者及び一般市民を対象とした治験に
係る情報提供の要領 第3版
• 「治験に係る情報提供の取扱いに
ついて」
(令和5年1月24日 薬生監麻発0124第1号)
• 企業の治験専用ウェブサイトにてjRCT
に登録されている治験情報を公開する
ことが可能。公開する際、平易な表現
とすることも可能
(令和5年11月1日 日本製薬工業協会 医薬品
評価委員会)
• 「治験に係る情報提供の取り扱いに関
する基本的な考え方」(令和5年6月1日)
は廃止(内容を包含するため)
• 治験に係る情報を求めている者に限定
した情報提供の場合は、jRCT及びUMIN
に登録された情報を、「治験に係る情
報提供の取扱いについて」に従い、
様々な情報提供媒体・方法を通じ提供
することが可能
• 「治験の実施状況等の登録について」
日本語版を患者等と共に
作成したり、自社治験情
報サイトやjRCTで公開す
る企業も出てきている
(令和2年8月31日 薬生薬審発0831第9号)
• 治験結果の概要の登録、原則として、
治験の終了後1年以内に結果をjRCTに
登録すること
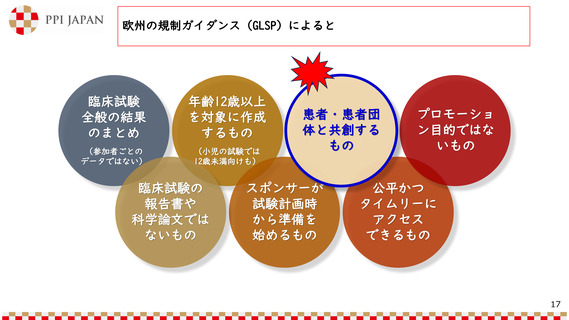
• 「臨床試験にみんながアクセス
しやすい社会を創る会」の発足
(令和5年6月8日、日本製薬工業協会 患者団
体連携推進委員会が事務局)
https://www.jpma.or.jp/information/patie
nt/tsukurukai/index.html
18
• 患者及び一般市民を対象とした治験に
係る情報提供の要領 第3版
• 「治験に係る情報提供の取扱いに
ついて」
(令和5年1月24日 薬生監麻発0124第1号)
• 企業の治験専用ウェブサイトにてjRCT
に登録されている治験情報を公開する
ことが可能。公開する際、平易な表現
とすることも可能
(令和5年11月1日 日本製薬工業協会 医薬品
評価委員会)
• 「治験に係る情報提供の取り扱いに関
する基本的な考え方」(令和5年6月1日)
は廃止(内容を包含するため)
• 治験に係る情報を求めている者に限定
した情報提供の場合は、jRCT及びUMIN
に登録された情報を、「治験に係る情
報提供の取扱いについて」に従い、
様々な情報提供媒体・方法を通じ提供
することが可能
• 「治験の実施状況等の登録について」
日本語版を患者等と共に
作成したり、自社治験情
報サイトやjRCTで公開す
る企業も出てきている
(令和2年8月31日 薬生薬審発0831第9号)
• 治験結果の概要の登録、原則として、
治験の終了後1年以内に結果をjRCTに
登録すること
• 「臨床試験にみんながアクセス
しやすい社会を創る会」の発足
(令和5年6月8日、日本製薬工業協会 患者団
体連携推進委員会が事務局)
https://www.jpma.or.jp/information/patie
nt/tsukurukai/index.html
18