よむ、つかう、まなぶ。
資料1-1:一般社団法人ピー・ピー・アイ・ジャパン 八木参考人 提出資料 (27 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_52767.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第40回 2/26)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
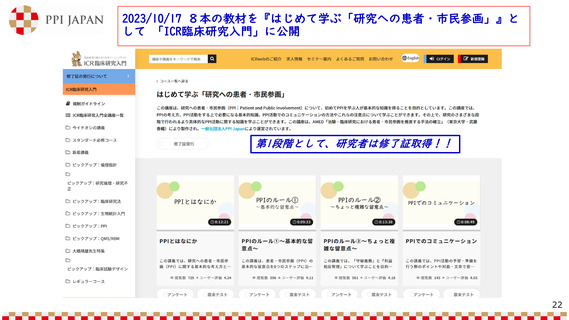
臨床研究・治験推進における患者・市民参画の促進、
そして、臨床研究中核病院への期待
(1)臨床研究中核病院の承認要件見直し
主な論点(案)
10月22日第37回臨床研究部会の資料1 p8の主な論点(案)再掲
◆現状の取組みを踏まえた臨床研究中核病院の役割・機能をどう考えるか。
• 臨床試験及び論文の評価基準をどのようにするか。
• 他施設支援については、どのように評価するか。
• 2019年版とりまとめにおいて、今後の見直しにおける要件化を見据えた事項を記載しているが、
今後どのように位置づけるか。(例:診療ガイドラインの策定を目的とした臨床試験、薬事申
請・承認実績、RWDの活用のための体制整備) 創薬への貢献度、国際共同治験、企業治験の評
価をどう考えるか。
• 他に評価する項目はあるか(例:DCT(※)、FMV(※)、キャリアトラック)。
※DCT(Decentralized Clinical Trials):分散型臨床試験、医療機関への来院に依らない治験
FMV(Fair Market Value) : 適切に情報が開示され,当事者間で独立性や競争性が十分に確保された条件
の下,買い手と売り手との間で誠実な交渉の
結果としてもたらされた,市場価格に基づく価格
➢ 臨床研究中核病院の新たな役割として、臨床研究・臨床試験におけるPPIの取り組み(担当部門、担
当窓口等の設置など)を支援している点を評価に加えることを検討してはどうか。
27
そして、臨床研究中核病院への期待
(1)臨床研究中核病院の承認要件見直し
主な論点(案)
10月22日第37回臨床研究部会の資料1 p8の主な論点(案)再掲
◆現状の取組みを踏まえた臨床研究中核病院の役割・機能をどう考えるか。
• 臨床試験及び論文の評価基準をどのようにするか。
• 他施設支援については、どのように評価するか。
• 2019年版とりまとめにおいて、今後の見直しにおける要件化を見据えた事項を記載しているが、
今後どのように位置づけるか。(例:診療ガイドラインの策定を目的とした臨床試験、薬事申
請・承認実績、RWDの活用のための体制整備) 創薬への貢献度、国際共同治験、企業治験の評
価をどう考えるか。
• 他に評価する項目はあるか(例:DCT(※)、FMV(※)、キャリアトラック)。
※DCT(Decentralized Clinical Trials):分散型臨床試験、医療機関への来院に依らない治験
FMV(Fair Market Value) : 適切に情報が開示され,当事者間で独立性や競争性が十分に確保された条件
の下,買い手と売り手との間で誠実な交渉の
結果としてもたらされた,市場価格に基づく価格
➢ 臨床研究中核病院の新たな役割として、臨床研究・臨床試験におけるPPIの取り組み(担当部門、担
当窓口等の設置など)を支援している点を評価に加えることを検討してはどうか。
27