よむ、つかう、まなぶ。
参考資料5 (14 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00016.html |
| 出典情報 | 患者申出療養評価会議(第30回 1/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
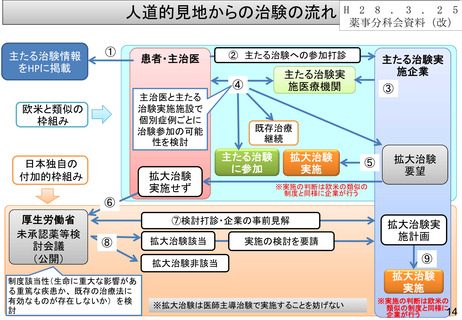
人道的見地からの治験の流れ
主たる治験情報
をHPに掲載
①
患者・主治医
② 主たる治験への参加打診
欧米と類似の
枠組み
日本独自の
付加的枠組み
拡大治験
実施せず
主たる治験実
施企業
主たる治験実
施医療機関
④
主治医と主たる
治験実施施設で
個別症例ごとに
治験参加の可能
性を検討
H 2 8 . 3 . 2 5
薬事分科会資料(改)
③
既存治療
継続
主たる治験
に参加
拡大治験
実施
⑤
拡大治験
要望
※実施の判断は欧米の類似の
制度と同様に企業が行う
⑥
厚生労働省
未承認薬等検
討会議
(公開)
⑦検討打診・企業の事前見解
⑧
制度該当性(生命に重大な影響があ
る重篤な疾患か、既存の治療法に
有効なものが存在しないか)を検
討
拡大治験該当
実施の検討を要請
拡大治験非該当
拡大治験実
施計画
⑨
拡大治験
実施
※拡大治験は医師主導治験で実施することを妨げない
※実施の判断は欧米の
類似の制度と同様に
14
企業が行う
主たる治験情報
をHPに掲載
①
患者・主治医
② 主たる治験への参加打診
欧米と類似の
枠組み
日本独自の
付加的枠組み
拡大治験
実施せず
主たる治験実
施企業
主たる治験実
施医療機関
④
主治医と主たる
治験実施施設で
個別症例ごとに
治験参加の可能
性を検討
H 2 8 . 3 . 2 5
薬事分科会資料(改)
③
既存治療
継続
主たる治験
に参加
拡大治験
実施
⑤
拡大治験
要望
※実施の判断は欧米の類似の
制度と同様に企業が行う
⑥
厚生労働省
未承認薬等検
討会議
(公開)
⑦検討打診・企業の事前見解
⑧
制度該当性(生命に重大な影響があ
る重篤な疾患か、既存の治療法に
有効なものが存在しないか)を検
討
拡大治験該当
実施の検討を要請
拡大治験非該当
拡大治験実
施計画
⑨
拡大治験
実施
※拡大治験は医師主導治験で実施することを妨げない
※実施の判断は欧米の
類似の制度と同様に
14
企業が行う