よむ、つかう、まなぶ。
参考資料5 (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00016.html |
| 出典情報 | 患者申出療養評価会議(第30回 1/21)《厚生労働省》 |
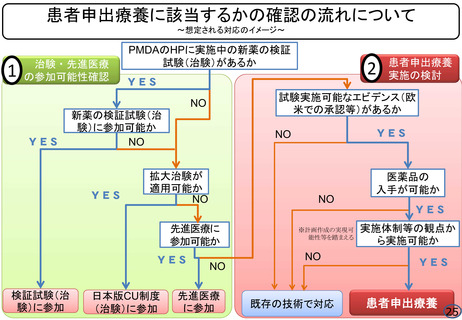
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
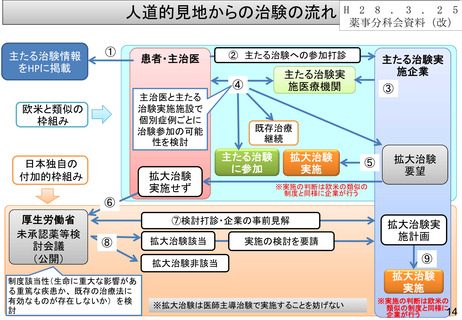
1.申出が予想される技術等について
○ 患者申出療養に係る申出の対象となる医療技術については、保険収載を目指さないものを除
き、以下のとおりの分類となることが考えられるのではないか。
1. 未承認等の医薬品等の使用及び医薬品等の適応外使用のいずれも伴わない医療技術
2. 未承認等の医薬品、医療機器若しくは再生医療等製品(以下「医薬品等」という。)の使用又は医薬
品等の適応外使用を伴う医療技術
a. 海外未承認の医薬品等
b. 海外承認国内未承認の医薬品等で、海外で承認されていない適応
c. 海外承認国内未承認の医薬品等で、海外で承認されている適応
d. 国内承認の医薬品等で、承認されていない適応
○ 患者が厚生労働大臣に申出を行うに当たっては、臨床研究中核病院の開設者が作成する意
見書を添えることが必要となるが、意見書作成を行うことができない場合としては、具体的には
以下のような事例が想定されるのではないか。
I.
II.
III.
科学的根拠等が不足している場合
① 実施計画を作成するに当たって、依拠するデータや論文等が不足している場合
② 保険収載を見据えたロードマップを作成することが困難である場合
③ 患者に安全性上の問題等が生じることが予想される場合
相談を受けた臨床研究中核病院より専門的な対応が可能な他の臨床研究中核病院がある場合
医薬品等が入手不可能である場合
4
○ 患者申出療養に係る申出の対象となる医療技術については、保険収載を目指さないものを除
き、以下のとおりの分類となることが考えられるのではないか。
1. 未承認等の医薬品等の使用及び医薬品等の適応外使用のいずれも伴わない医療技術
2. 未承認等の医薬品、医療機器若しくは再生医療等製品(以下「医薬品等」という。)の使用又は医薬
品等の適応外使用を伴う医療技術
a. 海外未承認の医薬品等
b. 海外承認国内未承認の医薬品等で、海外で承認されていない適応
c. 海外承認国内未承認の医薬品等で、海外で承認されている適応
d. 国内承認の医薬品等で、承認されていない適応
○ 患者が厚生労働大臣に申出を行うに当たっては、臨床研究中核病院の開設者が作成する意
見書を添えることが必要となるが、意見書作成を行うことができない場合としては、具体的には
以下のような事例が想定されるのではないか。
I.
II.
III.
科学的根拠等が不足している場合
① 実施計画を作成するに当たって、依拠するデータや論文等が不足している場合
② 保険収載を見据えたロードマップを作成することが困難である場合
③ 患者に安全性上の問題等が生じることが予想される場合
相談を受けた臨床研究中核病院より専門的な対応が可能な他の臨床研究中核病院がある場合
医薬品等が入手不可能である場合
4