よむ、つかう、まなぶ。
03【資料1】新型コロナワクチンの接種について (18 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27963.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会(第37回 9/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
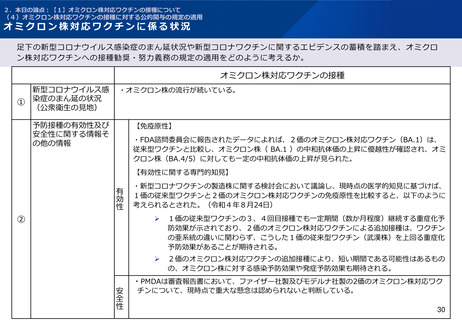
2.本日の論点:【1】オミクロン株対応ワクチンの接種について
(1)有効性及び安全性について
モデルナ社製2価のオミクロン株対応ワクチンの安全性(審査報告書)
PMDAは審査報告書において、モデルナ社の2価のオミクロン株対応ワクチンの追加接種について、従来型ワ
クチンの初回免疫時及び1回目追加接種時との比較においても安全性プロファイルに明確な差異はないとし、現時
点で重大な懸念は認められないと判断している。
※
抗原量は、従来型ワクチンでは初回接種100μg、追加接種50μgであり、2価のオミクロン株対応ワクチンにおいて
は、起源株25μg、オミクロン株25μgである。
モデルナ社臨床試験(PMDA提出資料)
モデルナ社の説明(抜粋・要約) :
反応原性事象(局所反応及び全身反応):2回目の追加接種としての2価(起源/
オミクロン)ワクチン50 μg接種後28日間に認められた非特定有害事象(治験薬接
種後7日間における特定有害事象を除く)及び副反応の発現割合は、それぞれ
18.5%(81/437例)及び5.7%(25/437例)であり、P205試験パートFにおけ
る、2回目の追加接種としての1価(起源)ワクチン50 μg接種後28日間の発現割
合と同程度であった。
有害事象:2回目の追加接種として2価ワクチン50 μgを接種した際の特定有害事象
の発現割合は、2回目の追加接種として1価ワクチン50 μgを接種した際の特定有害
事象の発現割合と同程度であり、Grade 3以上の事象についても、発現割合が高く
なる事象はなかった。
重篤な有害事象・死亡:データカットオフ日(2022年4月27日)までに、死亡に
至った有害事象、2価ワクチン接種との因果関係が否定されない重篤な有害事象及
び試験中止に至った有害事象は認められなかった。
心筋炎・心膜炎:2022年8月1日時点で、P205試験パートG及び実施中のP305試
験において、2価ワクチン接種後の心筋炎・心膜炎の報告はない。
PMDAの判断(抜粋・要約):
2回目追加接種時の安全性について、205試験のパートG及びパートFとの比較、並
びに1価(起源)ワクチンの初回免疫時及び1回目追加接種時との比較においても
安全性プロファイルに明確な差異はないことを確認し、現時点で重大な懸念は認め
られない。
2価ワクチンの評価例数は限られていることから、2価ワクチンにおいても、心筋
炎・心膜炎について1価ワクチンと同じ注意喚起を行うとともに、心筋炎・心膜炎
を含む2価ワクチンの安全性については引き続き情報収集し、得られた情報に基づ
き適宜対応を検討する必要がある。
2 価(起源/オミクロン)ワクチン接種後7 日間における接種回別の
特定有害事象の発現状況(特定有害事象解析対象集団、18 歳以上)
18
(1)有効性及び安全性について
モデルナ社製2価のオミクロン株対応ワクチンの安全性(審査報告書)
PMDAは審査報告書において、モデルナ社の2価のオミクロン株対応ワクチンの追加接種について、従来型ワ
クチンの初回免疫時及び1回目追加接種時との比較においても安全性プロファイルに明確な差異はないとし、現時
点で重大な懸念は認められないと判断している。
※
抗原量は、従来型ワクチンでは初回接種100μg、追加接種50μgであり、2価のオミクロン株対応ワクチンにおいて
は、起源株25μg、オミクロン株25μgである。
モデルナ社臨床試験(PMDA提出資料)
モデルナ社の説明(抜粋・要約) :
反応原性事象(局所反応及び全身反応):2回目の追加接種としての2価(起源/
オミクロン)ワクチン50 μg接種後28日間に認められた非特定有害事象(治験薬接
種後7日間における特定有害事象を除く)及び副反応の発現割合は、それぞれ
18.5%(81/437例)及び5.7%(25/437例)であり、P205試験パートFにおけ
る、2回目の追加接種としての1価(起源)ワクチン50 μg接種後28日間の発現割
合と同程度であった。
有害事象:2回目の追加接種として2価ワクチン50 μgを接種した際の特定有害事象
の発現割合は、2回目の追加接種として1価ワクチン50 μgを接種した際の特定有害
事象の発現割合と同程度であり、Grade 3以上の事象についても、発現割合が高く
なる事象はなかった。
重篤な有害事象・死亡:データカットオフ日(2022年4月27日)までに、死亡に
至った有害事象、2価ワクチン接種との因果関係が否定されない重篤な有害事象及
び試験中止に至った有害事象は認められなかった。
心筋炎・心膜炎:2022年8月1日時点で、P205試験パートG及び実施中のP305試
験において、2価ワクチン接種後の心筋炎・心膜炎の報告はない。
PMDAの判断(抜粋・要約):
2回目追加接種時の安全性について、205試験のパートG及びパートFとの比較、並
びに1価(起源)ワクチンの初回免疫時及び1回目追加接種時との比較においても
安全性プロファイルに明確な差異はないことを確認し、現時点で重大な懸念は認め
られない。
2価ワクチンの評価例数は限られていることから、2価ワクチンにおいても、心筋
炎・心膜炎について1価ワクチンと同じ注意喚起を行うとともに、心筋炎・心膜炎
を含む2価ワクチンの安全性については引き続き情報収集し、得られた情報に基づ
き適宜対応を検討する必要がある。
2 価(起源/オミクロン)ワクチン接種後7 日間における接種回別の
特定有害事象の発現状況(特定有害事象解析対象集団、18 歳以上)
18