よむ、つかう、まなぶ。
03【資料1】新型コロナワクチンの接種について (21 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27963.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会(第37回 9/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
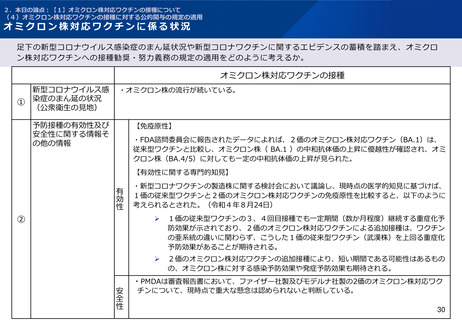
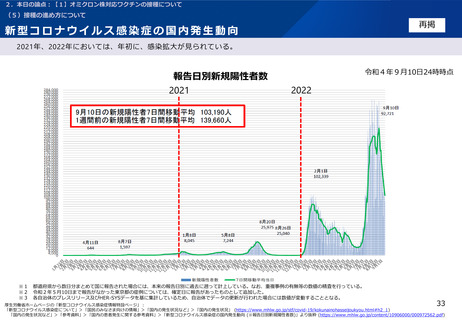
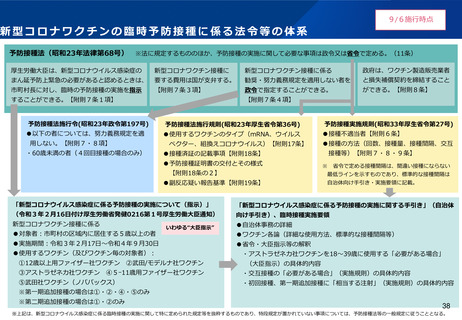
2.本日の論点:【1】オミクロン株対応ワクチンの接種について
(2)諸外国の状況について
2022年8月以降の海外の主な動向
JCVIステートメント
2022年秋のCOVID-19追加接種プログラムに関するJCVIステートメント1(抄、仮訳)[2022年8月15日]
以下の対象者に秋の追加接種を勧める。高齢者向け介護施設の入居者とスタッフ、第一線の医療・社会福祉従事者、50歳以上の者、5-49歳のハイリス
ク者、免疫抑制者と家庭内接触のある5-49歳の者、16-49歳の介護者。
秋のCOVID-19追加接種プログラムの主な目的は、2022年から2023年にかけての冬期において重症化リスクが高い人たちの免疫力を高めること。
適切なタイミングでワクチン接種を行うことは、使用するワクチンの種類よりも重要である。
2価ワクチンは、ワクチンにより誘導される免疫の幅を広げ、変異株に対する防御力を向上させる可能性がある。英国ではBA.1対応型ワクチンは2022
年秋に使用可能となる見込み。BA.4/5対応型ワクチンは2022年秋に使用できるようになる可能性は低く、順次検討される。BA.4/5対応型ワクチンが潜
在的に利用可能になる可能性があるからといって、秋のプログラムを遅らせるべきではない。
FDAの発表2(概要)[2022年8月31日]
2価ワクチン(オリジナル株とBA.4/5)を単回の追加接種として、初回接種もしくは追加接種から少なくとも2か月以降で使用できるように、EUAを修
正。
モデルナ社ワクチンは18歳以上、ファイザー社ワクチンは12歳以上に対して、単回の追加接種として承認された。
1価ワクチンの安全性・有効性、承認されたワクチンに類似したBA.1を含む2価ワクチンの臨床試験から得られた安全性・免疫原性データ、オリジナル
株とBA.4/5のmRNAを含む2価ワクチンの非臨床データなど、入手可能なエビデンス全体に基づいて決定を下した。
今後、1価のオリジナルワクチンは12歳以上の追加接種として用いることは認められなくなった。
EMAの発表3(概要)[2022年9月1日]
CHMP(ヒト用医薬品委員会)において、ファイザー社及びモデルナ社の二価ワクチン(起源株/BA.1株)の承認を勧告する意見を採択。
12歳以上を対象とする。追加接種として、前回接種から少なくとも3ヶ月以上の間隔を空けて接種。
ECDC-EMAの発表4(概要)[2022年9月6日]
最小の接種間隔は3ヶ月として承認されたが、リアルワールドでのエビデンスで追加接種(3回目接種)の効果が最低4ヶ月は持続することを踏まえ、
より長い接種間隔は考慮しえる。
長い接種間隔により強い免疫反応が得られるというエビデンスを踏まえれば、4ヶ月以上の接種間隔も考えられるが、効果が経時的に低下していくこと
と、地域的な流行状況を考慮して考えられるべきである。
※ 予防接種担当参事官室による仮訳。
1 JCVI, 2022. JCVI statement on the COVID-19 booster vaccination programme for autumn 2022: update 15 August (https://www.gov.uk/government/publications/covid-19-vaccines-for-autumn-2022-jcvi-advice-15august-2022)
2 FDA, 2022. Coronavirus (COVID-19) Update: FDA Authorizes Moderna, Pfizer-BioNTech Bivalent COVID-19 Vaccines for Use as a Booster Dose (https://www.fda.gov/news-events/press-announcements/coronaviruscovid-19-update-fda-authorizes-moderna-pfizer-biontech-bivalent-covid-19-vaccines-use)
3 EMA, 2022. First adapted COVID-19 booster vaccines recommended for approval in the EU (https://www.ema.europa.eu/en/news/first-adapted-covid-19-booster-vaccines-recommended-approval-eu)
4 ECDC, EMA, 2022. ECDC-EMA statement on booster vaccination with Omicron adapted bivalent COVID-19 vaccines (https://www.ecdc.europa.eu/sites/default/files/documents/ECDC-EMA-Statement-on-AdaptedVaccines.pdf)
21
(2)諸外国の状況について
2022年8月以降の海外の主な動向
JCVIステートメント
2022年秋のCOVID-19追加接種プログラムに関するJCVIステートメント1(抄、仮訳)[2022年8月15日]
以下の対象者に秋の追加接種を勧める。高齢者向け介護施設の入居者とスタッフ、第一線の医療・社会福祉従事者、50歳以上の者、5-49歳のハイリス
ク者、免疫抑制者と家庭内接触のある5-49歳の者、16-49歳の介護者。
秋のCOVID-19追加接種プログラムの主な目的は、2022年から2023年にかけての冬期において重症化リスクが高い人たちの免疫力を高めること。
適切なタイミングでワクチン接種を行うことは、使用するワクチンの種類よりも重要である。
2価ワクチンは、ワクチンにより誘導される免疫の幅を広げ、変異株に対する防御力を向上させる可能性がある。英国ではBA.1対応型ワクチンは2022
年秋に使用可能となる見込み。BA.4/5対応型ワクチンは2022年秋に使用できるようになる可能性は低く、順次検討される。BA.4/5対応型ワクチンが潜
在的に利用可能になる可能性があるからといって、秋のプログラムを遅らせるべきではない。
FDAの発表2(概要)[2022年8月31日]
2価ワクチン(オリジナル株とBA.4/5)を単回の追加接種として、初回接種もしくは追加接種から少なくとも2か月以降で使用できるように、EUAを修
正。
モデルナ社ワクチンは18歳以上、ファイザー社ワクチンは12歳以上に対して、単回の追加接種として承認された。
1価ワクチンの安全性・有効性、承認されたワクチンに類似したBA.1を含む2価ワクチンの臨床試験から得られた安全性・免疫原性データ、オリジナル
株とBA.4/5のmRNAを含む2価ワクチンの非臨床データなど、入手可能なエビデンス全体に基づいて決定を下した。
今後、1価のオリジナルワクチンは12歳以上の追加接種として用いることは認められなくなった。
EMAの発表3(概要)[2022年9月1日]
CHMP(ヒト用医薬品委員会)において、ファイザー社及びモデルナ社の二価ワクチン(起源株/BA.1株)の承認を勧告する意見を採択。
12歳以上を対象とする。追加接種として、前回接種から少なくとも3ヶ月以上の間隔を空けて接種。
ECDC-EMAの発表4(概要)[2022年9月6日]
最小の接種間隔は3ヶ月として承認されたが、リアルワールドでのエビデンスで追加接種(3回目接種)の効果が最低4ヶ月は持続することを踏まえ、
より長い接種間隔は考慮しえる。
長い接種間隔により強い免疫反応が得られるというエビデンスを踏まえれば、4ヶ月以上の接種間隔も考えられるが、効果が経時的に低下していくこと
と、地域的な流行状況を考慮して考えられるべきである。
※ 予防接種担当参事官室による仮訳。
1 JCVI, 2022. JCVI statement on the COVID-19 booster vaccination programme for autumn 2022: update 15 August (https://www.gov.uk/government/publications/covid-19-vaccines-for-autumn-2022-jcvi-advice-15august-2022)
2 FDA, 2022. Coronavirus (COVID-19) Update: FDA Authorizes Moderna, Pfizer-BioNTech Bivalent COVID-19 Vaccines for Use as a Booster Dose (https://www.fda.gov/news-events/press-announcements/coronaviruscovid-19-update-fda-authorizes-moderna-pfizer-biontech-bivalent-covid-19-vaccines-use)
3 EMA, 2022. First adapted COVID-19 booster vaccines recommended for approval in the EU (https://www.ema.europa.eu/en/news/first-adapted-covid-19-booster-vaccines-recommended-approval-eu)
4 ECDC, EMA, 2022. ECDC-EMA statement on booster vaccination with Omicron adapted bivalent COVID-19 vaccines (https://www.ecdc.europa.eu/sites/default/files/documents/ECDC-EMA-Statement-on-AdaptedVaccines.pdf)
21