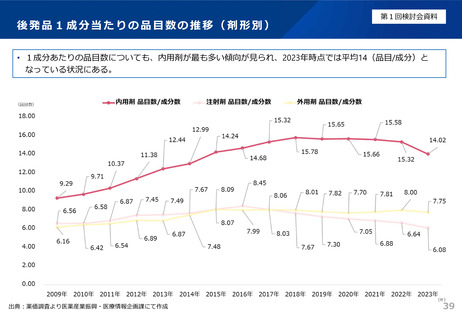
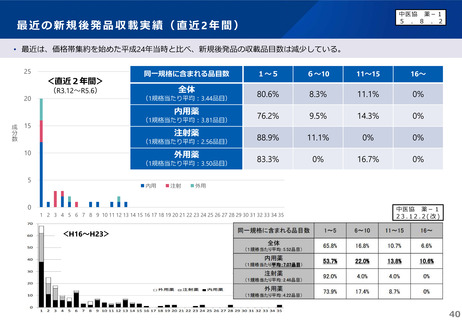
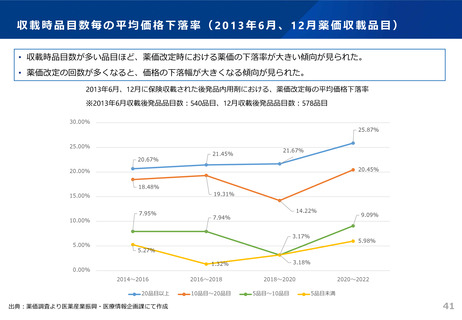
よむ、つかう、まなぶ。
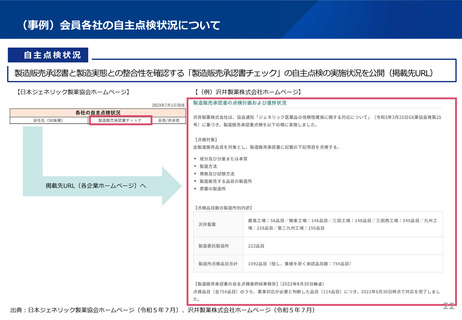
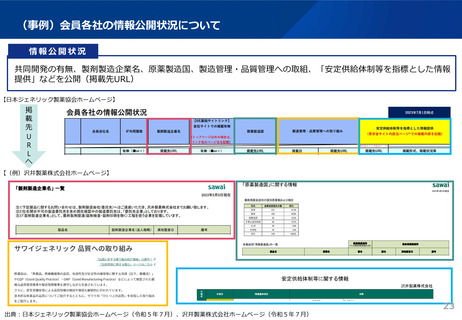
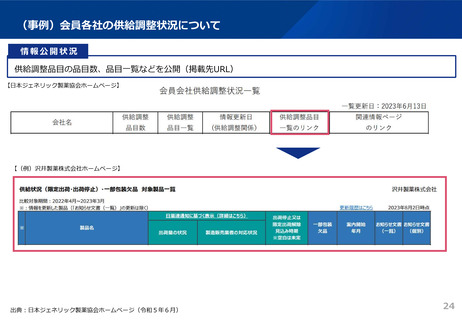
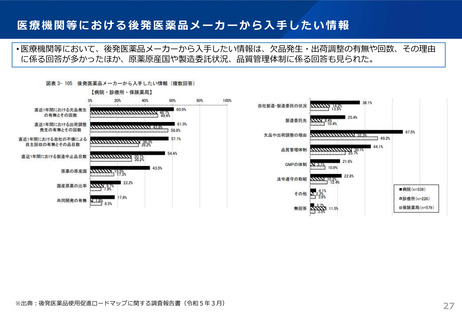
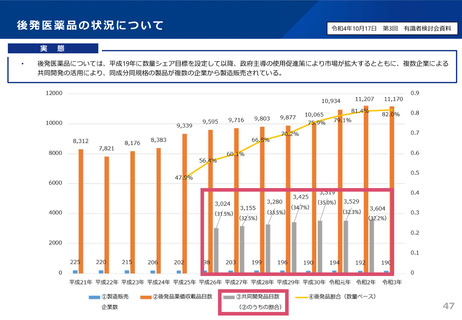
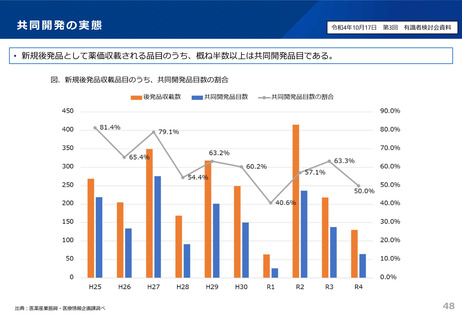
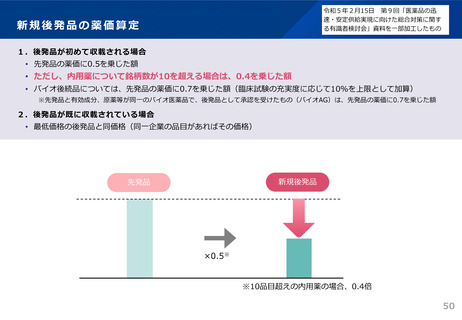
資料3 安定供給等の企業情報の可視化、少量多品目構造の解消(1) (44 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34767.html |
| 出典情報 | 後発医薬品の安定供給等の実現に向けた産業構造のあり方に関する検討会(第2回 8/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
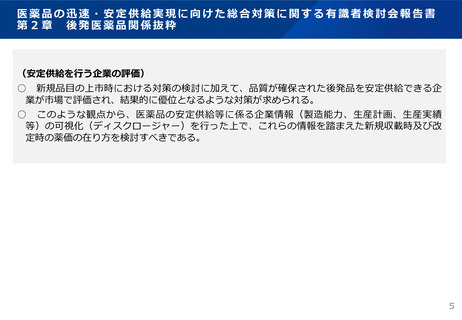
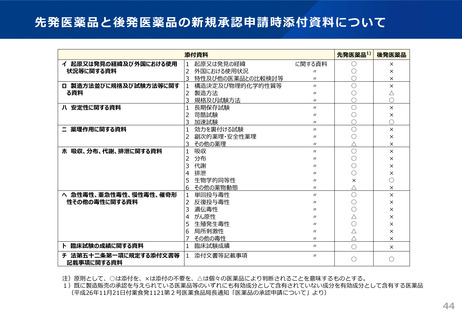
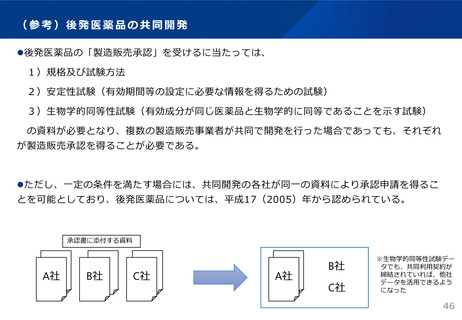
先 発 医 薬 品 と 後 発 医 薬 品の 新 規承 認 申請 時 添付 資 料に つ いて
添付資料
イ 起原又は発見の経緯及び外国における使用
状況等に関する資料
1 起原又は発見の経緯
2 外国における使用状況
3 特性及び他の医薬品との比較検討等
ロ 製造方法並びに規格及び試験方法等に関す 1 構造決定及び物理的化学的性質等
る資料
2 製造方法
3 規格及び試験方法
ハ 安定性に関する資料
1 長期保存試験
2 苛酷試験
3 加速試験
ニ 薬理作用に関する資料
1 効力を裏付ける試験
2 副次的薬理・安全性薬理
3 その他の薬理
ホ 吸収、分布、代謝、排泄に関する資料
1 吸収
2 分布
3 代謝
4 排泄
5 生物学的同等性
6 その他の薬物動態
ヘ 急性毒性、亜急性毒性、慢性毒性、催奇形 1 単回投与毒性
性その他の毒性に関する資料
2 反復投与毒性
3 遺伝毒性
4 がん原性
5 生殖発生毒性
6 局所刺激性
7 その他の毒性
ト 臨床試験の成績に関する資料
1 臨床試験成績
チ 法第五十二条第一項に規定する添付文書等 1 添付文書等記載事項
記載事項に関する資料
に関する資料
〃
〃
〃
〃
〃
〃
〃
〃
〃
〃
〃
〃
〃
〃
〃
〃
〃
〃
〃
〃
〃
〃
〃
〃
〃
〃
先発医薬品1) 後発医薬品
○
×
○
×
○
×
○
×
○
△
○
○
○
×
○
×
○
○
○
×
○
×
△
×
○
×
○
×
○
×
○
×
×
○
△
×
○
×
○
×
○
×
△
×
○
×
△
×
△
×
○
×
○
○
注)原則として、○は添付を、×は添付の不要を、△は個々の医薬品により判断されることを意味するものとする。
1)既に製造販売の承認を与えられている医薬品等のいずれにも有効成分として含有されていない成分を有効成分として含有する医薬品
(平成26年11月21日付薬食発1121第2号医薬食品局長通知「医薬品の承認申請について」より)
44
添付資料
イ 起原又は発見の経緯及び外国における使用
状況等に関する資料
1 起原又は発見の経緯
2 外国における使用状況
3 特性及び他の医薬品との比較検討等
ロ 製造方法並びに規格及び試験方法等に関す 1 構造決定及び物理的化学的性質等
る資料
2 製造方法
3 規格及び試験方法
ハ 安定性に関する資料
1 長期保存試験
2 苛酷試験
3 加速試験
ニ 薬理作用に関する資料
1 効力を裏付ける試験
2 副次的薬理・安全性薬理
3 その他の薬理
ホ 吸収、分布、代謝、排泄に関する資料
1 吸収
2 分布
3 代謝
4 排泄
5 生物学的同等性
6 その他の薬物動態
ヘ 急性毒性、亜急性毒性、慢性毒性、催奇形 1 単回投与毒性
性その他の毒性に関する資料
2 反復投与毒性
3 遺伝毒性
4 がん原性
5 生殖発生毒性
6 局所刺激性
7 その他の毒性
ト 臨床試験の成績に関する資料
1 臨床試験成績
チ 法第五十二条第一項に規定する添付文書等 1 添付文書等記載事項
記載事項に関する資料
に関する資料
〃
〃
〃
〃
〃
〃
〃
〃
〃
〃
〃
〃
〃
〃
〃
〃
〃
〃
〃
〃
〃
〃
〃
〃
〃
〃
先発医薬品1) 後発医薬品
○
×
○
×
○
×
○
×
○
△
○
○
○
×
○
×
○
○
○
×
○
×
△
×
○
×
○
×
○
×
○
×
×
○
△
×
○
×
○
×
○
×
△
×
○
×
△
×
△
×
○
×
○
○
注)原則として、○は添付を、×は添付の不要を、△は個々の医薬品により判断されることを意味するものとする。
1)既に製造販売の承認を与えられている医薬品等のいずれにも有効成分として含有されていない成分を有効成分として含有する医薬品
(平成26年11月21日付薬食発1121第2号医薬食品局長通知「医薬品の承認申請について」より)
44