よむ、つかう、まなぶ。
資料3 安定供給等の企業情報の可視化、少量多品目構造の解消(1) (49 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34767.html |
| 出典情報 | 後発医薬品の安定供給等の実現に向けた産業構造のあり方に関する検討会(第2回 8/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
後 発 品 の 承 認 審 査 時 に おけ る 対応 ( 令和 3 年7 月 )
○
○
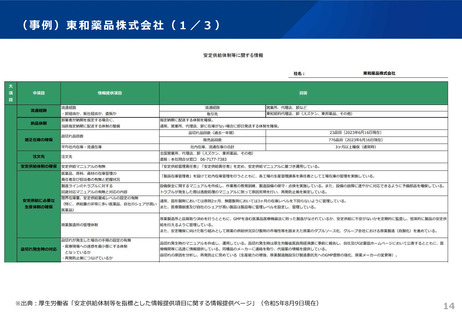
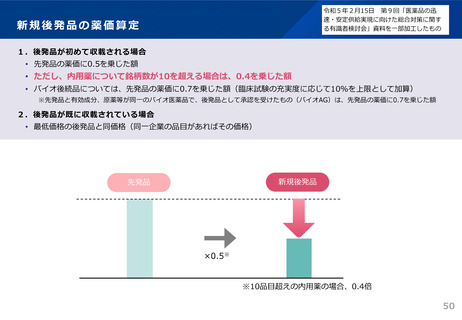
後発品の承認審査時において、以下の事項について確認することとした。
(令和3年7月2日付け通知「医療用後発医薬品の承認審査時における新たな対応について」)
また、承認申請資料の信頼性確保を目的として、調査対象品目を増やすなど、承認申
請資料適合性調査の体制を強化。
新 承認申請者の責任の確認
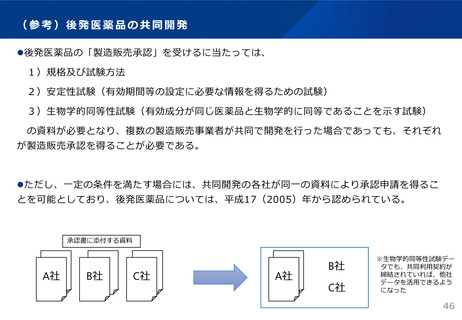
○ 共同開発であっても自社開発と同様に製品データ(承認申請資料)を作成・把握する責任
があることから、それが担保されているか確認する。
・ 承認申請時の添付資料として、製品データへ実際にアクセスでき、信頼性を確認できる
規定が盛り込まれている共同開発契約書、さらには、実際にどのように製品データを確認
したかを説明する資料の提出を求める。
・ 承認審査において、当該資料を厳格に確認・評価する。
新 製造・品質管理体制の確認
○ 製造品目数、製造量等に見合った管理体制が確保されているか確認する。
・ 承認時のGMP調査において、当該申請品目の製造所における、製造品目数、製造量等に
見合った製造・品質管理体制が確保されていることを確認する。
→
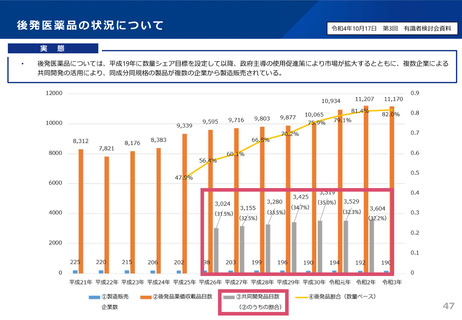
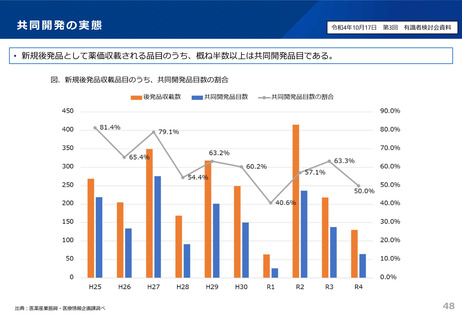
後発品の申請件数は、平成29~令和2年度は年間平均約400件であったが、通知発出後の
令和3年度は約200件に減少。引き続き、承認審査時において必要な確認を強化していく。
49
○
○
後発品の承認審査時において、以下の事項について確認することとした。
(令和3年7月2日付け通知「医療用後発医薬品の承認審査時における新たな対応について」)
また、承認申請資料の信頼性確保を目的として、調査対象品目を増やすなど、承認申
請資料適合性調査の体制を強化。
新 承認申請者の責任の確認
○ 共同開発であっても自社開発と同様に製品データ(承認申請資料)を作成・把握する責任
があることから、それが担保されているか確認する。
・ 承認申請時の添付資料として、製品データへ実際にアクセスでき、信頼性を確認できる
規定が盛り込まれている共同開発契約書、さらには、実際にどのように製品データを確認
したかを説明する資料の提出を求める。
・ 承認審査において、当該資料を厳格に確認・評価する。
新 製造・品質管理体制の確認
○ 製造品目数、製造量等に見合った管理体制が確保されているか確認する。
・ 承認時のGMP調査において、当該申請品目の製造所における、製造品目数、製造量等に
見合った製造・品質管理体制が確保されていることを確認する。
→
後発品の申請件数は、平成29~令和2年度は年間平均約400件であったが、通知発出後の
令和3年度は約200件に減少。引き続き、承認審査時において必要な確認を強化していく。
49