よむ、つかう、まなぶ。
薬-3○関係業界からの意見聴取について (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212451_00073.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第209回 9/20)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
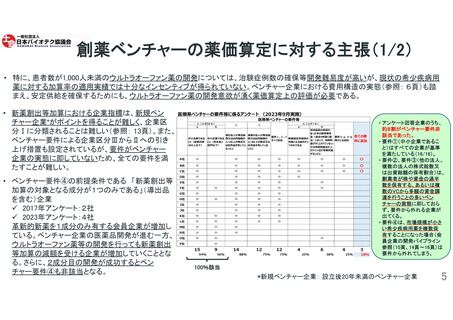
海外開発に関するアンケート結果(自由記述欄より抜粋)
日本での開発をためらう理由
海外開発を先行せざるを得ない理由
薬価
•
日本よりも高い薬価が期待できること。
•
製剤工夫等による付加価値が価格に反映されやす
いと考えている。
•
薬価水準の高い米国での開発・事業化を先行させ
経営基盤の安定化を図る。
臨床試験
•
市場性・事業性・先進性
•
市場規模の大きさ・成長性がある。
•
米国は世界最大の医薬品市場であり、そこで承認
を得ることが世界標準となる近道である。
•
海外であれば事業性が成立する患者数が見込める
ため。
•
米国での開発を先行させたうえで日本開発を進め
ていくことが、経営上合理的である。
•
米国は細胞医療の先進国であり、バイオベン
チャーへの投資理解も深く、将来的なビジネス展
開を見据え、米国での治験等を先行して進める可
能性はある。
•
臨床試験の質が優れている。例えばPOCに関する
臨床試験で、特にNew Modalityを用いた場合に、
その効果を数多くのバイオマーカーやValidateさ
れた臨床評価システムで多方面から有効性を評価
するような臨床試験計画が組まれることがあった。
初めからNature ScienceやLancet Oncologyなど
への投稿を念頭に置いて臨床試験計画を組むこと
が常であるが、まだ日本では追い付いていないと
感じる。
他国の臨床試験データの利用に積極的かつ柔軟で
あるため、臨床開発期間が短くコストも低くなる
と期待されること。その結果、より早く患者に画
期的な医薬品を届けるという当社のミッションに
適う可能性が高いため。
薬価
•
薬価がまったく期待できないこと。
•
製剤工夫等による付加価値が価格に反映されにくいと考
えている。
•
原価計算方式では、あくまで医薬品原料の値段からス
タートするので、低分子医薬品では高薬価が取りにくい。
•
遺伝子治療などの新しい医薬品でも、既存の医薬品開発
と同様の治験と症例数が求められ、そのコストを十分に
償却できない薬価となった場合、開発コストの回収が見
込めず、承認申請に踏み切れないこともある。
•
条件・期限付承認制度についても、制度はあるが、具体
的な手続きや明確な基準がなく、手探りのため、期間内
に本申請に移れない。
市場性・事業性・先進性
•
その他
•
米国のKOLと緊密な関係を構築済みであるため。
日本における当該疾患の患者数では事業性が成立しない
ため。
臨床試験
•
疾患に対する評価方法などが国内ではよく整備されてお
らず、ブリッジングも上手くできるかどうかわからない。
•
•
ゲノム編集や遺伝子治療などの最先端テクノロ
ジーを利用した治療薬の開発は、米国が圧倒的に
進捗しており米国での開発が合理的である。
他国の臨床試験データの利用の障壁が高く、国内での追
加試験の実施を要求される可能性が高いため、臨床開発
の長期化とコスト増大の恐れが強いこと。その結果、当
該製品のNPVが著しく下がる、あるいは日本のみ主要項
目の未達を招きかねないため。
•
特許保有地域であり、細胞治療と市場との親和性
がある。
12
日本での開発をためらう理由
海外開発を先行せざるを得ない理由
薬価
•
日本よりも高い薬価が期待できること。
•
製剤工夫等による付加価値が価格に反映されやす
いと考えている。
•
薬価水準の高い米国での開発・事業化を先行させ
経営基盤の安定化を図る。
臨床試験
•
市場性・事業性・先進性
•
市場規模の大きさ・成長性がある。
•
米国は世界最大の医薬品市場であり、そこで承認
を得ることが世界標準となる近道である。
•
海外であれば事業性が成立する患者数が見込める
ため。
•
米国での開発を先行させたうえで日本開発を進め
ていくことが、経営上合理的である。
•
米国は細胞医療の先進国であり、バイオベン
チャーへの投資理解も深く、将来的なビジネス展
開を見据え、米国での治験等を先行して進める可
能性はある。
•
臨床試験の質が優れている。例えばPOCに関する
臨床試験で、特にNew Modalityを用いた場合に、
その効果を数多くのバイオマーカーやValidateさ
れた臨床評価システムで多方面から有効性を評価
するような臨床試験計画が組まれることがあった。
初めからNature ScienceやLancet Oncologyなど
への投稿を念頭に置いて臨床試験計画を組むこと
が常であるが、まだ日本では追い付いていないと
感じる。
他国の臨床試験データの利用に積極的かつ柔軟で
あるため、臨床開発期間が短くコストも低くなる
と期待されること。その結果、より早く患者に画
期的な医薬品を届けるという当社のミッションに
適う可能性が高いため。
薬価
•
薬価がまったく期待できないこと。
•
製剤工夫等による付加価値が価格に反映されにくいと考
えている。
•
原価計算方式では、あくまで医薬品原料の値段からス
タートするので、低分子医薬品では高薬価が取りにくい。
•
遺伝子治療などの新しい医薬品でも、既存の医薬品開発
と同様の治験と症例数が求められ、そのコストを十分に
償却できない薬価となった場合、開発コストの回収が見
込めず、承認申請に踏み切れないこともある。
•
条件・期限付承認制度についても、制度はあるが、具体
的な手続きや明確な基準がなく、手探りのため、期間内
に本申請に移れない。
市場性・事業性・先進性
•
その他
•
米国のKOLと緊密な関係を構築済みであるため。
日本における当該疾患の患者数では事業性が成立しない
ため。
臨床試験
•
疾患に対する評価方法などが国内ではよく整備されてお
らず、ブリッジングも上手くできるかどうかわからない。
•
•
ゲノム編集や遺伝子治療などの最先端テクノロ
ジーを利用した治療薬の開発は、米国が圧倒的に
進捗しており米国での開発が合理的である。
他国の臨床試験データの利用の障壁が高く、国内での追
加試験の実施を要求される可能性が高いため、臨床開発
の長期化とコスト増大の恐れが強いこと。その結果、当
該製品のNPVが著しく下がる、あるいは日本のみ主要項
目の未達を招きかねないため。
•
特許保有地域であり、細胞治療と市場との親和性
がある。
12