よむ、つかう、まなぶ。
○医薬品の新規薬価収載について 総-5-1 (16 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00223.html |
| 出典情報 | 中央社会保険医療協議会 総会(第564回 11/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
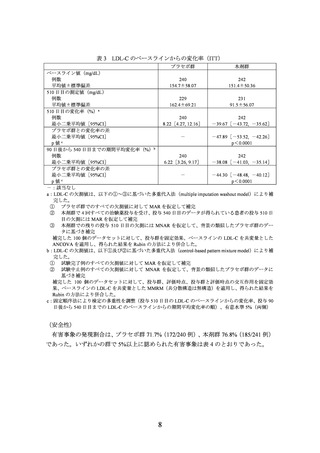
表10 LDLアフェレシス実施有無別及びLDLR遺伝子型別の
投与150日目のLDL-Cのベースラインからの変化率(部分集団解析)
プラセボ群 a,c
本剤群 a,c
1.65
[-45.23, 48.53]
(7)
6.51
[-22.51, 35.53]
(12)
19.95
[-7.90, 47.80]
(13)
-11.56
[-27.18, 4.05]
(24)
群間差 b
LDL アフェレシス
実施
非実施
18.30
[-35.36, 71.97]
-18.07
[-51.70, 15.56]
LDLR 遺伝子型
7.97
8.41
0.44
[-31.64, 47.58]
[-12.05, 28.87]
[-45.61, 46.49]
(3)
(10)
-2.83
2.49
-5.32
[-23.81, 28.79]
非 null/null 型
[-21.57, 15.90]
[-38.44, 27.79]
(16)
(27)
a:最小二乗平均値[95%CI]
(例数)
、b:最小二乗平均値[95%CI]
c:欠測値は、multiple imputation washout model(表 9 脚注参照)に基づく多重代入法により補完
した。補完後のデータセットに対して、二重盲検期間の投与群を固定効果、ベースラインの LDL
コレステロールを共変量として、投与群間の不等分散を仮定した共分散分析を適用し、Rubin の
方法により併合した。
null/null 型
(安全性)
二重盲検期間における有害事象の発現割合は、プラセボ群 31.6%(6/19 例)、本剤群
35.1%(13/37 例)であった。いずれかの群で 2 例以上に認められた有害事象は、ウイル
ス性気道感染(プラセボ群 10.5%(2/19 例)、本剤群 5.4%(2/37 例)、以下同順)、下
痢(0%(0/19 例)、5.4%(2/37 例))、発熱(0%(0/19 例)、5.4%(2/37 例))であ
った。
二重盲検期間における副作用の発現割合は、プラセボ群 0%(0/19 例)、本剤群 5.4%
(2/37 例:下痢・発熱、下痢各 1 例)であった。
非盲検期間における有害事象の発現割合は、プラセボ/本剤群で 57.9%(11/19 例)、
本剤/本剤群で 55.9%(19/34 例)であった。いずれかの群で 2 例以上に認められた有害
事象は、コロナウイルス感染(プラセボ/本剤群 5.3%(1/19 例)、本剤/本剤群 8.8%(3/34
例)、以下同順)、国際標準比増加(5.3%(1/19 例)、5.9%(2/34 例))、狭心症(0%
(0/19 例)、5.9%(2/34 例))、大動脈硬化症(0%(0/19 例)、5.9%(2/34 例))、
大動脈弁狭窄(0%(0/19 例)、5.9%(2/34 例))、糖尿病(0%(0/19 例)、5.9%(2/34
例))、肺炎(0%(0/19 例)、5.9%(2/34 例))、鼻漏(0%(0/19 例)、5.9%(2/34
例))であった。
非盲検期間における副作用の発現割合は、プラセボ群 0%(0/19 例)、本剤群 2.9%
(1/34 例:注射部位紅斑)であった。
15
投与150日目のLDL-Cのベースラインからの変化率(部分集団解析)
プラセボ群 a,c
本剤群 a,c
1.65
[-45.23, 48.53]
(7)
6.51
[-22.51, 35.53]
(12)
19.95
[-7.90, 47.80]
(13)
-11.56
[-27.18, 4.05]
(24)
群間差 b
LDL アフェレシス
実施
非実施
18.30
[-35.36, 71.97]
-18.07
[-51.70, 15.56]
LDLR 遺伝子型
7.97
8.41
0.44
[-31.64, 47.58]
[-12.05, 28.87]
[-45.61, 46.49]
(3)
(10)
-2.83
2.49
-5.32
[-23.81, 28.79]
非 null/null 型
[-21.57, 15.90]
[-38.44, 27.79]
(16)
(27)
a:最小二乗平均値[95%CI]
(例数)
、b:最小二乗平均値[95%CI]
c:欠測値は、multiple imputation washout model(表 9 脚注参照)に基づく多重代入法により補完
した。補完後のデータセットに対して、二重盲検期間の投与群を固定効果、ベースラインの LDL
コレステロールを共変量として、投与群間の不等分散を仮定した共分散分析を適用し、Rubin の
方法により併合した。
null/null 型
(安全性)
二重盲検期間における有害事象の発現割合は、プラセボ群 31.6%(6/19 例)、本剤群
35.1%(13/37 例)であった。いずれかの群で 2 例以上に認められた有害事象は、ウイル
ス性気道感染(プラセボ群 10.5%(2/19 例)、本剤群 5.4%(2/37 例)、以下同順)、下
痢(0%(0/19 例)、5.4%(2/37 例))、発熱(0%(0/19 例)、5.4%(2/37 例))であ
った。
二重盲検期間における副作用の発現割合は、プラセボ群 0%(0/19 例)、本剤群 5.4%
(2/37 例:下痢・発熱、下痢各 1 例)であった。
非盲検期間における有害事象の発現割合は、プラセボ/本剤群で 57.9%(11/19 例)、
本剤/本剤群で 55.9%(19/34 例)であった。いずれかの群で 2 例以上に認められた有害
事象は、コロナウイルス感染(プラセボ/本剤群 5.3%(1/19 例)、本剤/本剤群 8.8%(3/34
例)、以下同順)、国際標準比増加(5.3%(1/19 例)、5.9%(2/34 例))、狭心症(0%
(0/19 例)、5.9%(2/34 例))、大動脈硬化症(0%(0/19 例)、5.9%(2/34 例))、
大動脈弁狭窄(0%(0/19 例)、5.9%(2/34 例))、糖尿病(0%(0/19 例)、5.9%(2/34
例))、肺炎(0%(0/19 例)、5.9%(2/34 例))、鼻漏(0%(0/19 例)、5.9%(2/34
例))であった。
非盲検期間における副作用の発現割合は、プラセボ群 0%(0/19 例)、本剤群 2.9%
(1/34 例:注射部位紅斑)であった。
15