よむ、つかう、まなぶ。
○医薬品の新規薬価収載について 総-5-2 (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00223.html |
| 出典情報 | 中央社会保険医療協議会 総会(第564回 11/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
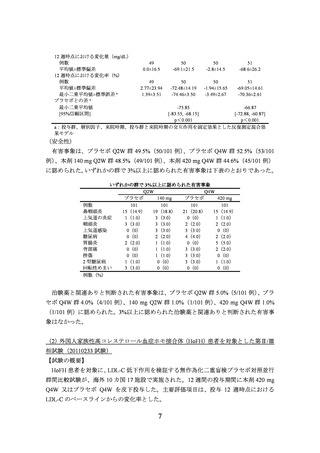
Q4W 群 0%(0/33 例)に認められた。いずれかの群で複数例に認められた治験薬と関連
ありと判断された有害事象はなかった。
(3)スタチンによる治療が適さない高コレステロール血症患者を対象とした国内第Ⅲ
相試験(20140234 試験)
【試験の概要】
筋肉関連の副作用のため有効用量のスタチンが投与できず、LDL-C をコントロール
できない日本人高コレステロール血症患者を対象に、国内 30 施設において、本剤の LDLC 低下作用を検証するための無作為化二重盲検エゼチミブ対照並行群間比較試験が実
施された。
4 週間以上有効用量未満のスタチンで治療を受けている又はスタチンによる治療を受
けていない患者に対し、治療を継続したまま、本剤 140mg を 2 週間に 1 回(Q2W)若
しくは本剤 420mg を 4 週間に 1 回(Q4W)皮下投与、又はエゼチミブ 10mg を 1 日 1 回
12 週間経口投与した。12 週以降は、全ての患者に非盲検下で本剤を二重盲検期に割り
付けられた本剤又は本剤プラセボの投与間隔に対応する本剤の用法・用量(140 mg Q2W
又は 420 mg Q4W)で 40 週間皮下投与した。主要評価項目は、投与 10 週時点及び 12 週
時点の LDL-C の平均値のベースラインからの変化率、並びに投与 12 週時点の LDL-C
のベースラインからの変化率とした。
対象となる患者は、20 歳以上 80 歳以下の高コレステロール血症患者で、スクリーニ
ング時に以下の基準を満たすことが条件とされた。
(主な選択基準)
以下のいずれかに該当する患者
‐CHD の既往を有する又は同等の CHD リスクを有する患者
‐JAS ガイドライン 2012 の一次予防カテゴリーⅢ、Ⅱ又はⅠの患者
2 種類以上のスタチンの投与を試みたが、耐え難い筋肉痛(CK 値上昇を伴わない筋
肉の疼痛、うずき又は筋力低下)
、筋炎(CK 値上昇を伴う筋肉症状)又は横紋筋融解
症(CK 値の顕著な上昇を伴う筋肉症状)のため、1 種類以上のスタチンで規定用量
(アトルバスタチン 10 mg、フルバスタチン 20 mg、プラバスタチン 10 mg、ロスバ
スタチン 2.5 mg、シンバスタチン 5 mg 又はピタバスタチン 1 mg、その他のスタチン
は承認された最低開始用量)又はそれ以下の用量に不忍容であった患者(※)
(※)CK 値が ULN の 10 倍以上と定義される横紋筋融解症を発症した患者は、用量を問わず 1 種類
のみのスタチンに不忍容な場合でも対象とされた
血清中 LDL-C が 100 mg/dL 以上(CHD の既往を有する又は同等の CHD リスクを有
する患者)
、血清中 LDL-C が 120 mg/dL 以上(一次予防カテゴリーⅢの患者)
、血清
中 LDL-C が 140 mg/dL 以上(一次予防カテゴリーⅡの患者)又は血清中 LDL-C が
160 mg/dL 以上(一次予防カテゴリーⅠの患者)
9
ありと判断された有害事象はなかった。
(3)スタチンによる治療が適さない高コレステロール血症患者を対象とした国内第Ⅲ
相試験(20140234 試験)
【試験の概要】
筋肉関連の副作用のため有効用量のスタチンが投与できず、LDL-C をコントロール
できない日本人高コレステロール血症患者を対象に、国内 30 施設において、本剤の LDLC 低下作用を検証するための無作為化二重盲検エゼチミブ対照並行群間比較試験が実
施された。
4 週間以上有効用量未満のスタチンで治療を受けている又はスタチンによる治療を受
けていない患者に対し、治療を継続したまま、本剤 140mg を 2 週間に 1 回(Q2W)若
しくは本剤 420mg を 4 週間に 1 回(Q4W)皮下投与、又はエゼチミブ 10mg を 1 日 1 回
12 週間経口投与した。12 週以降は、全ての患者に非盲検下で本剤を二重盲検期に割り
付けられた本剤又は本剤プラセボの投与間隔に対応する本剤の用法・用量(140 mg Q2W
又は 420 mg Q4W)で 40 週間皮下投与した。主要評価項目は、投与 10 週時点及び 12 週
時点の LDL-C の平均値のベースラインからの変化率、並びに投与 12 週時点の LDL-C
のベースラインからの変化率とした。
対象となる患者は、20 歳以上 80 歳以下の高コレステロール血症患者で、スクリーニ
ング時に以下の基準を満たすことが条件とされた。
(主な選択基準)
以下のいずれかに該当する患者
‐CHD の既往を有する又は同等の CHD リスクを有する患者
‐JAS ガイドライン 2012 の一次予防カテゴリーⅢ、Ⅱ又はⅠの患者
2 種類以上のスタチンの投与を試みたが、耐え難い筋肉痛(CK 値上昇を伴わない筋
肉の疼痛、うずき又は筋力低下)
、筋炎(CK 値上昇を伴う筋肉症状)又は横紋筋融解
症(CK 値の顕著な上昇を伴う筋肉症状)のため、1 種類以上のスタチンで規定用量
(アトルバスタチン 10 mg、フルバスタチン 20 mg、プラバスタチン 10 mg、ロスバ
スタチン 2.5 mg、シンバスタチン 5 mg 又はピタバスタチン 1 mg、その他のスタチン
は承認された最低開始用量)又はそれ以下の用量に不忍容であった患者(※)
(※)CK 値が ULN の 10 倍以上と定義される横紋筋融解症を発症した患者は、用量を問わず 1 種類
のみのスタチンに不忍容な場合でも対象とされた
血清中 LDL-C が 100 mg/dL 以上(CHD の既往を有する又は同等の CHD リスクを有
する患者)
、血清中 LDL-C が 120 mg/dL 以上(一次予防カテゴリーⅢの患者)
、血清
中 LDL-C が 140 mg/dL 以上(一次予防カテゴリーⅡの患者)又は血清中 LDL-C が
160 mg/dL 以上(一次予防カテゴリーⅠの患者)
9