よむ、つかう、まなぶ。
○医薬品の新規薬価収載について 総-5-2 (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00223.html |
| 出典情報 | 中央社会保険医療協議会 総会(第564回 11/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
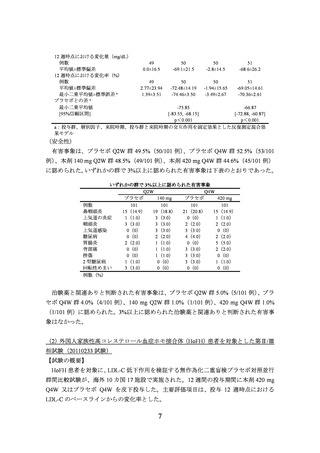
対象となる患者は、HoFH の遺伝子診断が確定した 12 歳以上 80 歳以下の患者、又は
未治療時の LDL-C が 500 mg/dL 超の既往があり、
10 歳未満での黄色腫又は両親の HeFH
の所見に基づき、臨床的に HoFH と診断された患者でスクリーニング時に以下の基準を
満たすこととされた。
(主な選択基準)
空腹時 LDL-C が 130 mg/dL 以上
空腹時 TG が 400 mg/dL 以下
組入れの 8 週前以降に LDL 又は血漿アフェレーシスを受けていない
【結果】
有効性及び安全性の主要な解析対象集団は、プラセボ Q4W 群 16 例、本剤 Q4W 群 33
例であった。
(有効性)
本剤はプラセボと比較して有意に LDL-C 値を低下させることが示された。
投与 12 週時点における LDL-C のベースラインからの変化率(FAS)
LDL-C(超遠心法)
LDL-C(算出法)
プラセボ
本剤
プラセボ
本剤
ベースライン値(mg/dL)
例数
16
33
16
33
平均値±標準偏差
335.8±146.0
356.0±134.5
335.0±144.8
354.5±136.4
12 週時点の値(mg/dL)
例数
15
29
16
29
平均値±標準偏差
363.8±164.3
274.2±161.2
357.4±160.2
274.9±162.1
12 週時点の変化量(mg/dL)
例数
15
29
16
29
平均値±標準偏差
19.5±67.4
-79.1±84.4
22.4±64.5
-78.6±82.2
12 週時点の変化率(%)
例数
15
29
16
29
平均値±標準偏差
6.11±18.25
-26.07±23.21
7.45±19.32
-25.94±22.85
最小二乗平均値±標準誤差 a
7.88±5.26
-23.05±3.78
9.02±5.23
-23.09±3.83
プラセボとの差 a
-30.93
-32.12
最小二乗平均値
[-43.86, -18.00]
[-45.05, -19.18]
[95%信頼区間]
p<0.001
p<0.001
a:投与群、スクリーニング時の LDL-C 値(420 mg/dL 未満、420 mg/dL 以上)
、来院時期、投与群
と来院時期の交互作用を固定効果とした反復測定混合効果モデル
(安全性)
有害事象は、プラセボ Q4W 群 62.5%(10/16 例)
、本剤 Q4W 群 36.4%(12/33 例)に
認められた。いずれかの群で複数例に認められた有害事象は、上気道感染 4 例(プラセ
ボ群 1 例、本剤群 3 例、以下同順)
、インフルエンザ(0 例、3 例)
、胃腸炎(0 例、2 例)
、
鼻咽頭炎(0 例、2 例)及び悪心(2 例、0 例)であった。
治験薬と関連ありと判断された有害事象は、プラセボ Q4W 群 12.5%(2/16 例)
、本剤
8
未治療時の LDL-C が 500 mg/dL 超の既往があり、
10 歳未満での黄色腫又は両親の HeFH
の所見に基づき、臨床的に HoFH と診断された患者でスクリーニング時に以下の基準を
満たすこととされた。
(主な選択基準)
空腹時 LDL-C が 130 mg/dL 以上
空腹時 TG が 400 mg/dL 以下
組入れの 8 週前以降に LDL 又は血漿アフェレーシスを受けていない
【結果】
有効性及び安全性の主要な解析対象集団は、プラセボ Q4W 群 16 例、本剤 Q4W 群 33
例であった。
(有効性)
本剤はプラセボと比較して有意に LDL-C 値を低下させることが示された。
投与 12 週時点における LDL-C のベースラインからの変化率(FAS)
LDL-C(超遠心法)
LDL-C(算出法)
プラセボ
本剤
プラセボ
本剤
ベースライン値(mg/dL)
例数
16
33
16
33
平均値±標準偏差
335.8±146.0
356.0±134.5
335.0±144.8
354.5±136.4
12 週時点の値(mg/dL)
例数
15
29
16
29
平均値±標準偏差
363.8±164.3
274.2±161.2
357.4±160.2
274.9±162.1
12 週時点の変化量(mg/dL)
例数
15
29
16
29
平均値±標準偏差
19.5±67.4
-79.1±84.4
22.4±64.5
-78.6±82.2
12 週時点の変化率(%)
例数
15
29
16
29
平均値±標準偏差
6.11±18.25
-26.07±23.21
7.45±19.32
-25.94±22.85
最小二乗平均値±標準誤差 a
7.88±5.26
-23.05±3.78
9.02±5.23
-23.09±3.83
プラセボとの差 a
-30.93
-32.12
最小二乗平均値
[-43.86, -18.00]
[-45.05, -19.18]
[95%信頼区間]
p<0.001
p<0.001
a:投与群、スクリーニング時の LDL-C 値(420 mg/dL 未満、420 mg/dL 以上)
、来院時期、投与群
と来院時期の交互作用を固定効果とした反復測定混合効果モデル
(安全性)
有害事象は、プラセボ Q4W 群 62.5%(10/16 例)
、本剤 Q4W 群 36.4%(12/33 例)に
認められた。いずれかの群で複数例に認められた有害事象は、上気道感染 4 例(プラセ
ボ群 1 例、本剤群 3 例、以下同順)
、インフルエンザ(0 例、3 例)
、胃腸炎(0 例、2 例)
、
鼻咽頭炎(0 例、2 例)及び悪心(2 例、0 例)であった。
治験薬と関連ありと判断された有害事象は、プラセボ Q4W 群 12.5%(2/16 例)
、本剤
8