よむ、つかう、まなぶ。
○医薬品の新規薬価収載について 総-5-2 (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00223.html |
| 出典情報 | 中央社会保険医療協議会 総会(第564回 11/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
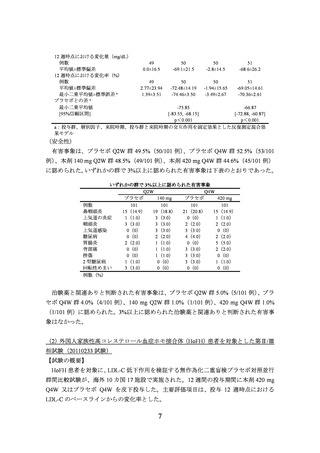
12 週時点における変化量(mg/dL)
例数
平均値±標準偏差
12 週時点における変化率(%)
例数
平均値±標準偏差
最小二乗平均値±標準誤差 a
プラセボとの差 a
最小二乗平均値
[95%信頼区間]
49
0.0±16.5
50
-69.1±21.5
50
-2.8±14.5
51
-68.6±26.2
49
2.77±23.94
1.39±3.51
50
-72.48±14.19
-74.46±3.50
50
-1.94±15.65
-3.49±2.67
51
-69.05±14.61
-70.36±2.61
-75.85
-66.87
[-83.55, -68.15]
[-72.88, -60.87]
p<0.001
p<0.001
a:投与群、層別因子、来院時期、投与群と来院時期の交互作用を固定効果とした反復測定混合効
果モデル
(安全性)
有害事象は、プラセボ Q2W 群 49.5%(50/101 例)
、プラセボ Q4W 群 52.5%(53/101
例)、本剤 140 mg Q2W 群 48.5%(49/101 例)
、本剤 420 mg Q4W 群 44.6%(45/101 例)
に認められた。いずれかの群で 3%以上に認められた有害事象は下表のとおりであった。
いずれかの群で 3%以上に認められた有害事象
Q2W
Q4W
プラセボ
140 mg
プラセボ
420 mg
例数
101
101
101
101
鼻咽頭炎
15(14.9)
19(18.8) 21(20.8)
15(14.9)
上気道の炎症
1(1.0)
3(3.0)
0(0)
1(1.0)
咽頭炎
3(3.0)
3(3.0)
2(2.0)
2(2.0)
上気道感染
0(0)
3(3.0)
3(3.0)
0(0)
糖尿病
0(0)
2(2.0)
4(4.0)
2(2.0)
胃腸炎
2(2.0)
1(1.0)
0(0)
5(5.0)
背部痛
0(0)
1(1.0)
3(3.0)
2(2.0)
挫傷
0(0)
1(1.0)
3(3.0)
0(0)
2 型糖尿病
1(1.0)
0(0)
3(3.0)
1(1.0)
回転性めまい
3(3.0)
0(0)
0(0)
0(0)
例数(%)
治験薬と関連ありと判断された有害事象は、プラセボ Q2W 群 5.0%(5/101 例)
、プラ
セボ Q4W 群 4.0%(4/101 例)、140 mg Q2W 群 1.0%(1/101 例)
、420 mg Q4W 群 1.0%
(1/101 例)に認められた。3%以上に認められた治験薬と関連ありと判断された有害事
象はなかった。
(2)外国人家族性高コレステロール血症ホモ接合体(HoFH)患者を対象とした第Ⅱ/Ⅲ
相試験(20110233 試験)
【試験の概要】
HoFH 患者を対象に、LDL-C 低下作用を検証する無作為化二重盲検プラセボ対照並行
群間比較試験が、海外 10 カ国 17 施設で実施された。12 週間の投与期間に本剤 420 mg
Q4W 又はプラセボ Q4W を皮下投与した。主要評価項目は、投与 12 週時点における
LDL-C のベースラインからの変化率とした。
7
例数
平均値±標準偏差
12 週時点における変化率(%)
例数
平均値±標準偏差
最小二乗平均値±標準誤差 a
プラセボとの差 a
最小二乗平均値
[95%信頼区間]
49
0.0±16.5
50
-69.1±21.5
50
-2.8±14.5
51
-68.6±26.2
49
2.77±23.94
1.39±3.51
50
-72.48±14.19
-74.46±3.50
50
-1.94±15.65
-3.49±2.67
51
-69.05±14.61
-70.36±2.61
-75.85
-66.87
[-83.55, -68.15]
[-72.88, -60.87]
p<0.001
p<0.001
a:投与群、層別因子、来院時期、投与群と来院時期の交互作用を固定効果とした反復測定混合効
果モデル
(安全性)
有害事象は、プラセボ Q2W 群 49.5%(50/101 例)
、プラセボ Q4W 群 52.5%(53/101
例)、本剤 140 mg Q2W 群 48.5%(49/101 例)
、本剤 420 mg Q4W 群 44.6%(45/101 例)
に認められた。いずれかの群で 3%以上に認められた有害事象は下表のとおりであった。
いずれかの群で 3%以上に認められた有害事象
Q2W
Q4W
プラセボ
140 mg
プラセボ
420 mg
例数
101
101
101
101
鼻咽頭炎
15(14.9)
19(18.8) 21(20.8)
15(14.9)
上気道の炎症
1(1.0)
3(3.0)
0(0)
1(1.0)
咽頭炎
3(3.0)
3(3.0)
2(2.0)
2(2.0)
上気道感染
0(0)
3(3.0)
3(3.0)
0(0)
糖尿病
0(0)
2(2.0)
4(4.0)
2(2.0)
胃腸炎
2(2.0)
1(1.0)
0(0)
5(5.0)
背部痛
0(0)
1(1.0)
3(3.0)
2(2.0)
挫傷
0(0)
1(1.0)
3(3.0)
0(0)
2 型糖尿病
1(1.0)
0(0)
3(3.0)
1(1.0)
回転性めまい
3(3.0)
0(0)
0(0)
0(0)
例数(%)
治験薬と関連ありと判断された有害事象は、プラセボ Q2W 群 5.0%(5/101 例)
、プラ
セボ Q4W 群 4.0%(4/101 例)、140 mg Q2W 群 1.0%(1/101 例)
、420 mg Q4W 群 1.0%
(1/101 例)に認められた。3%以上に認められた治験薬と関連ありと判断された有害事
象はなかった。
(2)外国人家族性高コレステロール血症ホモ接合体(HoFH)患者を対象とした第Ⅱ/Ⅲ
相試験(20110233 試験)
【試験の概要】
HoFH 患者を対象に、LDL-C 低下作用を検証する無作為化二重盲検プラセボ対照並行
群間比較試験が、海外 10 カ国 17 施設で実施された。12 週間の投与期間に本剤 420 mg
Q4W 又はプラセボ Q4W を皮下投与した。主要評価項目は、投与 12 週時点における
LDL-C のベースラインからの変化率とした。
7