よむ、つかう、まなぶ。
○医薬品の新規薬価収載について 総-5-2 (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00223.html |
| 出典情報 | 中央社会保険医療協議会 総会(第564回 11/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
[95%信頼区間]
[-48.68, -31.60]
p<0.0001
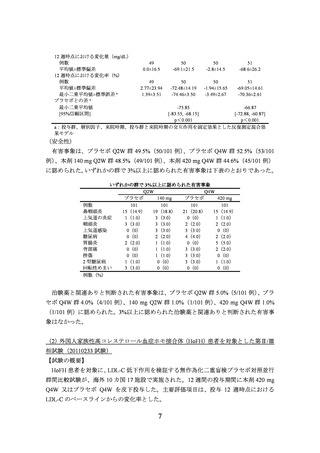
a:投与群、層別因子、来院時期、投与群と来院時期の交互作用を固定効果とした反復測定混合効
果モデル
(安全性)
有害事象は、二重盲検期ではエゼチミブ群 61.9%(13/21 例)
、本剤併合群 57.5%(23/40
例)であり、主な事象は以下のとおりであった。
二重盲検期(投与 12 週まで)にいずれかの群で 5%以上に認められた有害事象
(安全性解析対象集団)
例数
上咽頭炎
咽頭炎
下痢
注射部位疼痛
咳嗽
腹部膨満
高血圧
%(例数)
エゼチミブ群
本剤併合群
21
4.8(1)
0(0)
9.5(2)
4.8(1)
4.8(1)
0(0)
0(0)
40
12.5(5)
10.0(4)
5.0(2)
5.0(2)
5.0(2)
5.0(2)
5.0(2)
治験薬と関連ありと判断された有害事象は、エゼチミブ群 14.3%(3/21 例)
、本剤併
合群 17.5%(7/40 例)に認められた。
非盲検期(投与 12 週から 52 週までの 40 週間)には、58 例の患者に本剤が投与され
た。この期間に認められた有害事象について二重盲検期の群ごとの発現割合は、エゼチ
ミブ群 80.0%(16/20 例)
、本剤併合群 78.9%(30/38 例)であり、主な事象は以下のとお
りであった。
非盲検期(投与 12 週から 52 週まで)にいずれかの群で 5%以上に認められた有害事象
(安全性解析対象集団)
二重盲検期における投与群 a
例数
上咽頭炎
背部痛
湿疹
高血圧
便秘
胃腸炎
インフルエンザ
腰部脊柱管狭窄症
肋間神経痛
咳嗽
エゼチミブ群
本剤併合群
20
45.0(9)
5.0(1)
5.0(1)
5.0(1)
0(0)
0(0)
0(0)
0(0)
0(0)
0(0)
38
21.1(8)
7.9(3)
7.9(3)
5.3(2)
5.3(2)
5.3(2)
5.3(2)
5.3(2)
5.3(2)
5.3(2)
11
[-48.68, -31.60]
p<0.0001
a:投与群、層別因子、来院時期、投与群と来院時期の交互作用を固定効果とした反復測定混合効
果モデル
(安全性)
有害事象は、二重盲検期ではエゼチミブ群 61.9%(13/21 例)
、本剤併合群 57.5%(23/40
例)であり、主な事象は以下のとおりであった。
二重盲検期(投与 12 週まで)にいずれかの群で 5%以上に認められた有害事象
(安全性解析対象集団)
例数
上咽頭炎
咽頭炎
下痢
注射部位疼痛
咳嗽
腹部膨満
高血圧
%(例数)
エゼチミブ群
本剤併合群
21
4.8(1)
0(0)
9.5(2)
4.8(1)
4.8(1)
0(0)
0(0)
40
12.5(5)
10.0(4)
5.0(2)
5.0(2)
5.0(2)
5.0(2)
5.0(2)
治験薬と関連ありと判断された有害事象は、エゼチミブ群 14.3%(3/21 例)
、本剤併
合群 17.5%(7/40 例)に認められた。
非盲検期(投与 12 週から 52 週までの 40 週間)には、58 例の患者に本剤が投与され
た。この期間に認められた有害事象について二重盲検期の群ごとの発現割合は、エゼチ
ミブ群 80.0%(16/20 例)
、本剤併合群 78.9%(30/38 例)であり、主な事象は以下のとお
りであった。
非盲検期(投与 12 週から 52 週まで)にいずれかの群で 5%以上に認められた有害事象
(安全性解析対象集団)
二重盲検期における投与群 a
例数
上咽頭炎
背部痛
湿疹
高血圧
便秘
胃腸炎
インフルエンザ
腰部脊柱管狭窄症
肋間神経痛
咳嗽
エゼチミブ群
本剤併合群
20
45.0(9)
5.0(1)
5.0(1)
5.0(1)
0(0)
0(0)
0(0)
0(0)
0(0)
0(0)
38
21.1(8)
7.9(3)
7.9(3)
5.3(2)
5.3(2)
5.3(2)
5.3(2)
5.3(2)
5.3(2)
5.3(2)
11