よむ、つかう、まなぶ。
○最適使用推進ガイドラインについて(報告) 総ー6参考3 (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00231.html |
| 出典情報 | 中央社会保険医療協議会 総会(第572回 12/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
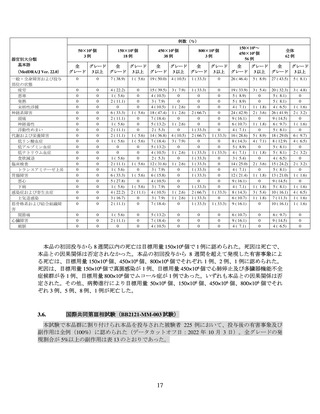
ジメン(DPd4)、DVd5)、IRd6)、Kd7)又は EPd8))のうちいずれかを 1 サイクル以下で実施するこ
ととされ9)、LD 化学療法の開始より 14 日前までに完了することとされた。
標準治療群の用法及び用量又は使用方法は、無作為化後 1 日目から、患者の直近の前治療レジメ
ンに基づき、治験責任医師の判断により、DPd、DVd、IRd、Kd 又は EPd のうちいずれかの化学療法
レジメンを実施された。なお、標準治療群の患者は、IRC 判定により PD が確認され、かつ本品投与
の適格性が確認された場合に、治験責任医師からの要請に基づき本品のクロスオーバー投与10)が可
能とされた。
(1)前処置の LD 化学療法
シクロホスファミド 300 mg/m2 及びフルダラビン 30 mg/m2 をいずれも 1 日 1 回、3 日間点滴静脈内
投与した。また、患者の状態(腎機能障害等)に応じてフルダラビンの投与量の減量が行われた。
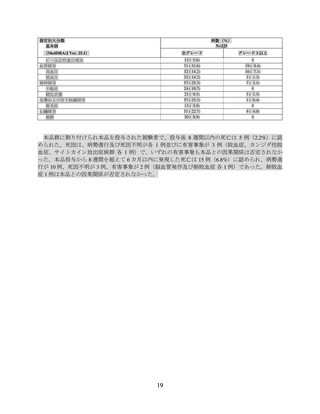
(2)MM-003 試験の臨床成績
MM は既存の治療法では治癒が困難な再発を繰り返す難治性の疾患であり、無増悪生存期間(以
下、「PFS」)の延長により、症状の改善、病勢進行の遅延、次治療までの期間の延長等が期待さ
れることから、本試験の主要評価項目は PFS とされ、PFS は無作為化から最初の病勢進行又は死因
を問わない死亡のいずれか早い時点までの期間と定義された。有効性の主要解析には、IMWG 基準
(Lancet Oncol 2016; 17: e328-46)に従った IRC 判定に基づく治療効果データが用いられた。主要評
価項目である PFS の結果(2022 年 4 月 18 日データカットオフ)は表 7 及び図 1 のとおりであり、標
準治療群に対する本品群の優越性が示された(片側 p 値<0.001、有意水準片側 0.014、層別ログラン
ク検定)。
4)
1 サイクルを 28 日間として、DARA 16 mg/kg を、第 1~2 サイクルは第 1、8、15 及び 22 日目に静脈内投与、第 3
~6 サイクルは第 1 及び 15 日目に静脈内投与、第 7 サイクル以降は第 1 日目に静脈内投与。POM 4 mg を、各サイ
クルの第 1~21 日目に経口投与。DEX 40 mg(75 歳以上の患者では 20 mg)を、各サイクルの第 1、8、15 及び 22
日目に投与。
5)
1 サイクルを 21 日間として、DARA 16 mg/kg を、第 1~3 サイクルは第 1、8 及び 15 日目に静脈内投与、第 4~8 サ
イクルは第 1 日目に静脈内投与、第 9 サイクル以降は 1 サイクルを 28 日間として、第 1 日目に静脈内投与。BTZ
1.3 mg/m2 を、第 1~8 サイクルは第 1、4、8 及び 11 日目に皮下投与、第 9 サイクル以降は投与を中止する。DEX
20 mg を、第 1~8 サイクルの第 1、2、4、5、8、9、11 及び 12 日目に投与(75 歳以上、BMI 18.5 kg/m2 未満、糖
尿病合併又はステロイド治療に対する忍容性に問題がある患者では週 20 mg)。第 9 サイクル以降は DEX の投与
を中止する。
6)
1 サイクルを 28 日間として、IXA 4 mg を第 1、8 及び 15 日目に経口投与、LEN 25 mg を第 1~21 日目に経口投与、
DEX 40 mg を第 1、8、15 及び 22 日目に経口投与。
7)
1 サイクルを 28 日間として、第 1 サイクルでは CFZ 20 mg/m2 を第 1 及び 2 日目、CFZ 56 mg/m2 を第 8、9、15 及び
16 日目に静脈内投与。第 2 サイクル以降は CFZ 56 mg/m2 を各サイクルの第 1、2、8、9、15 及び 16 日目に静脈内
投与。DEX 20 mg を各サイクルの第 1、2、8、9、15、16、22 及び 23 日目に経口投与。
8)
1 サイクルを 28 日間として、第 1 及び 2 サイクルでは ELO 10 mg/kg を第 1、8、15 及び 22 日目、第 3 サイクル以
降では ELO 20 mg/kg を第 1 日目に静脈内投与。POM 4 mg を第 1~21 日目に経口投与、75 歳以下の患者には、
DEX 40 mg(75 歳以上の患者では週 20 mg)を第 1、8、15 及び 22 日目に経口投与。ELO 投与日のみ DEX 28 mg
経口投与及び 8 mg 静脈内投与。
9)
ITT 集団の本品群 254 例のうち 213 例がブリッジング療法を受けた。ブリッジング療法で投与された主な抗骨髄腫
薬(25%以上の患者に投与)は、POM 48.4%(123 例)、DARA 31.9%(81 例)及び ELO 26.4%(67 例)であっ
た。
10) 標準治療群の 70 例は本品のクロスオーバー投与が適切と判断され、1 例(死亡)を除く 69 例に白血球アフェレー
シスが実施され、9 例(死亡 2 例、治療基準に不適合 2 例、同意撤回 2 例、製造失敗 1 例、データカットオフ時点
で本品投与前の 2 例)を除く 60 例に本品が投与された(2022 年 4 月 18 日データカットオフ)。
10
ととされ9)、LD 化学療法の開始より 14 日前までに完了することとされた。
標準治療群の用法及び用量又は使用方法は、無作為化後 1 日目から、患者の直近の前治療レジメ
ンに基づき、治験責任医師の判断により、DPd、DVd、IRd、Kd 又は EPd のうちいずれかの化学療法
レジメンを実施された。なお、標準治療群の患者は、IRC 判定により PD が確認され、かつ本品投与
の適格性が確認された場合に、治験責任医師からの要請に基づき本品のクロスオーバー投与10)が可
能とされた。
(1)前処置の LD 化学療法
シクロホスファミド 300 mg/m2 及びフルダラビン 30 mg/m2 をいずれも 1 日 1 回、3 日間点滴静脈内
投与した。また、患者の状態(腎機能障害等)に応じてフルダラビンの投与量の減量が行われた。
(2)MM-003 試験の臨床成績
MM は既存の治療法では治癒が困難な再発を繰り返す難治性の疾患であり、無増悪生存期間(以
下、「PFS」)の延長により、症状の改善、病勢進行の遅延、次治療までの期間の延長等が期待さ
れることから、本試験の主要評価項目は PFS とされ、PFS は無作為化から最初の病勢進行又は死因
を問わない死亡のいずれか早い時点までの期間と定義された。有効性の主要解析には、IMWG 基準
(Lancet Oncol 2016; 17: e328-46)に従った IRC 判定に基づく治療効果データが用いられた。主要評
価項目である PFS の結果(2022 年 4 月 18 日データカットオフ)は表 7 及び図 1 のとおりであり、標
準治療群に対する本品群の優越性が示された(片側 p 値<0.001、有意水準片側 0.014、層別ログラン
ク検定)。
4)
1 サイクルを 28 日間として、DARA 16 mg/kg を、第 1~2 サイクルは第 1、8、15 及び 22 日目に静脈内投与、第 3
~6 サイクルは第 1 及び 15 日目に静脈内投与、第 7 サイクル以降は第 1 日目に静脈内投与。POM 4 mg を、各サイ
クルの第 1~21 日目に経口投与。DEX 40 mg(75 歳以上の患者では 20 mg)を、各サイクルの第 1、8、15 及び 22
日目に投与。
5)
1 サイクルを 21 日間として、DARA 16 mg/kg を、第 1~3 サイクルは第 1、8 及び 15 日目に静脈内投与、第 4~8 サ
イクルは第 1 日目に静脈内投与、第 9 サイクル以降は 1 サイクルを 28 日間として、第 1 日目に静脈内投与。BTZ
1.3 mg/m2 を、第 1~8 サイクルは第 1、4、8 及び 11 日目に皮下投与、第 9 サイクル以降は投与を中止する。DEX
20 mg を、第 1~8 サイクルの第 1、2、4、5、8、9、11 及び 12 日目に投与(75 歳以上、BMI 18.5 kg/m2 未満、糖
尿病合併又はステロイド治療に対する忍容性に問題がある患者では週 20 mg)。第 9 サイクル以降は DEX の投与
を中止する。
6)
1 サイクルを 28 日間として、IXA 4 mg を第 1、8 及び 15 日目に経口投与、LEN 25 mg を第 1~21 日目に経口投与、
DEX 40 mg を第 1、8、15 及び 22 日目に経口投与。
7)
1 サイクルを 28 日間として、第 1 サイクルでは CFZ 20 mg/m2 を第 1 及び 2 日目、CFZ 56 mg/m2 を第 8、9、15 及び
16 日目に静脈内投与。第 2 サイクル以降は CFZ 56 mg/m2 を各サイクルの第 1、2、8、9、15 及び 16 日目に静脈内
投与。DEX 20 mg を各サイクルの第 1、2、8、9、15、16、22 及び 23 日目に経口投与。
8)
1 サイクルを 28 日間として、第 1 及び 2 サイクルでは ELO 10 mg/kg を第 1、8、15 及び 22 日目、第 3 サイクル以
降では ELO 20 mg/kg を第 1 日目に静脈内投与。POM 4 mg を第 1~21 日目に経口投与、75 歳以下の患者には、
DEX 40 mg(75 歳以上の患者では週 20 mg)を第 1、8、15 及び 22 日目に経口投与。ELO 投与日のみ DEX 28 mg
経口投与及び 8 mg 静脈内投与。
9)
ITT 集団の本品群 254 例のうち 213 例がブリッジング療法を受けた。ブリッジング療法で投与された主な抗骨髄腫
薬(25%以上の患者に投与)は、POM 48.4%(123 例)、DARA 31.9%(81 例)及び ELO 26.4%(67 例)であっ
た。
10) 標準治療群の 70 例は本品のクロスオーバー投与が適切と判断され、1 例(死亡)を除く 69 例に白血球アフェレー
シスが実施され、9 例(死亡 2 例、治療基準に不適合 2 例、同意撤回 2 例、製造失敗 1 例、データカットオフ時点
で本品投与前の 2 例)を除く 60 例に本品が投与された(2022 年 4 月 18 日データカットオフ)。
10