よむ、つかう、まなぶ。
○最適使用推進ガイドラインについて(報告) 総ー6参考3 (19 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00231.html |
| 出典情報 | 中央社会保険医療協議会 総会(第572回 12/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
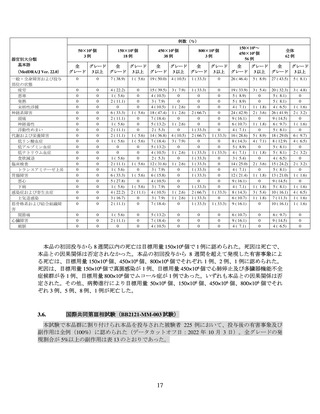
例数(%)
50×106 個
3例
器官別大分類
基本語
(MedDRA/J Ver. 22.0)
一般・全身障害および投与
部位の状態
疲労
悪寒
発熱
末梢性浮腫
神経系障害
頭痛
神経毒性
浮動性めまい
代謝および栄養障害
低リン酸血症
低アルブミン血症
低ナトリウム血症
食欲減退
臨床検査
トランスアミナーゼ上昇
胃腸障害
悪心
下痢
感染症および寄生虫症
上気道感染
筋骨格系および結合組織障
害
関節痛
心臓障害
頻脈
150×106 個
18 例
450×106 個
38 例
800×106 個
3例
150×106~
450×106 個
56 例
全体
62 例
全
グレード
全
グレード
全
グレード
全
グレード
全
グレード
全
グレード
グレード 3 以上 グレード 3 以上 グレード 3 以上 グレード 3 以上 グレード 3 以上 グレード 3 以上
0
0
7 ( 38.9)
1 ( 5.6)
19 ( 50.0)
4 ( 10.5)
1 ( 33.3)
0
26 ( 46.4)
5 ( 8.9)
27 ( 43.5)
5 ( 8.1)
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
4 ( 22.2)
1 ( 5.6)
2 ( 11.1)
0
6 ( 33.3)
2 ( 11.1)
1 ( 5.6)
2 ( 11.1)
2 ( 11.1)
1 ( 5.6)
0
0
1 ( 5.6)
2 ( 11.1)
1 ( 5.6)
6 ( 33.3)
5 ( 27.8)
1 ( 5.6)
4 ( 22.2)
3 ( 16.7)
2 ( 11.1)
0
0
0
0
1 ( 5.6)
0
0
0
1 ( 5.6)
1 ( 5.6)
0
0
0
1 ( 5.6)
0
1 ( 5.6)
0
1 ( 5.6)
2 ( 11.1)
0
0
15 ( 39.5)
4 ( 10.5)
3 ( 7.9)
4 ( 10.5)
18 ( 47.4)
7 ( 18.4)
5 ( 13.2)
2 ( 5.3)
14 ( 36.8)
7 ( 18.4)
5 ( 13.2)
4 ( 10.5)
2 ( 5.3)
12 ( 31.6)
3 ( 7.9)
6 ( 15.8)
4 ( 10.5)
3 ( 7.9)
4 ( 10.5)
3 ( 7.9)
7 ( 18.4)
3 ( 7.9)
0
0
1 ( 2.6)
1 ( 2.6)
0
1 ( 2.6)
0
4 ( 10.5)
3 ( 7.9)
0
1 ( 2.6)
0
1 ( 2.6)
0
0
0
0
1 ( 2.6)
1 ( 2.6)
0
1 ( 33.3)
0
0
0
2 ( 66.7)
0
0
1 ( 33.3)
2 ( 66.7)
0
0
1 ( 33.3)
1 ( 33.3)
1 ( 33.3)
1 ( 33.3)
1 ( 33.3)
0
1 ( 33.3)
2 ( 66.7)
1 ( 33.3)
1 ( 33.3)
0
0
0
0
0
0
0
0
1 ( 33.3)
0
0
1 ( 33.3)
0
0
0
0
0
0
1 ( 33.3)
0
1 ( 33.3)
19 ( 33.9)
5 ( 8.9)
5 ( 8.9)
4 ( 7.1)
24 ( 42.9)
9 ( 16.1)
6 ( 10.7)
4 ( 7.1)
16 ( 28.6)
8 ( 14.3)
5 ( 8.9)
4 ( 7.1)
3 ( 5.4)
14 ( 25.0)
4 ( 7.1)
12 ( 21.4)
9 ( 16.1)
4 ( 7.1)
8 ( 14.3)
6 ( 10.7)
9 ( 16.1)
3 ( 5.4)
0
0
1 ( 1.8)
2 ( 3.6)
0
1 ( 1.8)
0
5 ( 8.9)
4 ( 7.1)
0
1 ( 1.8)
0
2 ( 3.6)
0
1 ( 1.8)
0
1 ( 1.8)
3 ( 5.4)
1 ( 1.8)
0
20 ( 32.3)
5 ( 8.1)
5 ( 8.1)
4 ( 6.5)
26 ( 41.9)
9 ( 14.5)
6 ( 9.7)
5 ( 8.1)
18 ( 29.0)
8 ( 12.9)
5 ( 8.1)
5 ( 8.1)
4 ( 6.5)
15 ( 24.2)
5 ( 8.1)
13 ( 21.0)
9 ( 14.5)
5 ( 8.1)
10 ( 16.1)
7 ( 11.3)
10 ( 16.1)
3 ( 4.8)
0
0
1 ( 1.6)
2 ( 3.2)
0
1 ( 1.6)
0
6 ( 9.7)
4 ( 6.5)
0
2 ( 3.2)
0
2 ( 3.2)
0
1 ( 1.6)
0
1 ( 1.6)
4 ( 6.5)
1 ( 1.6)
1 ( 1.6)
0
0
0
0
0
0
1 ( 5.6)
2 ( 11.1)
0
0
0
0
5 ( 13.2)
7 ( 18.4)
4 ( 10.5)
0
0
0
0
0
0
0
0
0
6 ( 10.7)
9 ( 16.1)
4 ( 7.1)
0
0
0
6 ( 9.7)
9 ( 14.5)
4 ( 6.5)
0
0
0
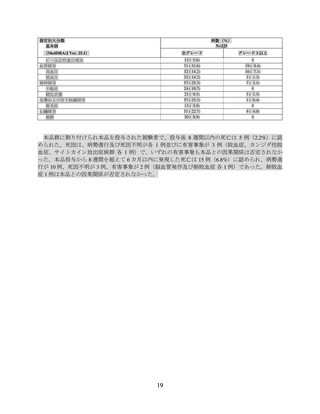
本品の初回投与から 8 週間以内の死亡は目標用量 150×106 個で 1 例に認められた。死因は死亡で、
本品との因果関係は否定されなかった。本品の初回投与から 8 週間を超えて発現した有害事象によ
る死亡は、目標用量 150×106 個、450×106 個、800×106 個でそれぞれ 1 例、2 例、1 例に認められた。
死因は、目標用量 150×106 個で真菌感染が 1 例、目標用量 450×106 個で心肺停止及び多臓器機能不全
症候群が各 1 例、目標用量 800×106 個でムコール症が 1 例であった。いずれも本品との因果関係は否
定された。その他、病勢進行により目標用量 50×106 個、150×106 個、450×106 個、800×106 個でそれ
ぞれ 3 例、5 例、8 例、1 例が死亡した。
3.6.
国際共同第Ⅲ相試験(BB2121-MM-003 試験)
本試験で本品群に割り付けられ本品を投与された被験者 225 例において、投与後の有害事象及び
副作用は全例(100%)に認められた(データカットオフ日:2022 年 10 月 3 日)。全グレードの発
現割合が 5%以上の副作用は表 13 のとおりであった。
17
50×106 個
3例
器官別大分類
基本語
(MedDRA/J Ver. 22.0)
一般・全身障害および投与
部位の状態
疲労
悪寒
発熱
末梢性浮腫
神経系障害
頭痛
神経毒性
浮動性めまい
代謝および栄養障害
低リン酸血症
低アルブミン血症
低ナトリウム血症
食欲減退
臨床検査
トランスアミナーゼ上昇
胃腸障害
悪心
下痢
感染症および寄生虫症
上気道感染
筋骨格系および結合組織障
害
関節痛
心臓障害
頻脈
150×106 個
18 例
450×106 個
38 例
800×106 個
3例
150×106~
450×106 個
56 例
全体
62 例
全
グレード
全
グレード
全
グレード
全
グレード
全
グレード
全
グレード
グレード 3 以上 グレード 3 以上 グレード 3 以上 グレード 3 以上 グレード 3 以上 グレード 3 以上
0
0
7 ( 38.9)
1 ( 5.6)
19 ( 50.0)
4 ( 10.5)
1 ( 33.3)
0
26 ( 46.4)
5 ( 8.9)
27 ( 43.5)
5 ( 8.1)
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
4 ( 22.2)
1 ( 5.6)
2 ( 11.1)
0
6 ( 33.3)
2 ( 11.1)
1 ( 5.6)
2 ( 11.1)
2 ( 11.1)
1 ( 5.6)
0
0
1 ( 5.6)
2 ( 11.1)
1 ( 5.6)
6 ( 33.3)
5 ( 27.8)
1 ( 5.6)
4 ( 22.2)
3 ( 16.7)
2 ( 11.1)
0
0
0
0
1 ( 5.6)
0
0
0
1 ( 5.6)
1 ( 5.6)
0
0
0
1 ( 5.6)
0
1 ( 5.6)
0
1 ( 5.6)
2 ( 11.1)
0
0
15 ( 39.5)
4 ( 10.5)
3 ( 7.9)
4 ( 10.5)
18 ( 47.4)
7 ( 18.4)
5 ( 13.2)
2 ( 5.3)
14 ( 36.8)
7 ( 18.4)
5 ( 13.2)
4 ( 10.5)
2 ( 5.3)
12 ( 31.6)
3 ( 7.9)
6 ( 15.8)
4 ( 10.5)
3 ( 7.9)
4 ( 10.5)
3 ( 7.9)
7 ( 18.4)
3 ( 7.9)
0
0
1 ( 2.6)
1 ( 2.6)
0
1 ( 2.6)
0
4 ( 10.5)
3 ( 7.9)
0
1 ( 2.6)
0
1 ( 2.6)
0
0
0
0
1 ( 2.6)
1 ( 2.6)
0
1 ( 33.3)
0
0
0
2 ( 66.7)
0
0
1 ( 33.3)
2 ( 66.7)
0
0
1 ( 33.3)
1 ( 33.3)
1 ( 33.3)
1 ( 33.3)
1 ( 33.3)
0
1 ( 33.3)
2 ( 66.7)
1 ( 33.3)
1 ( 33.3)
0
0
0
0
0
0
0
0
1 ( 33.3)
0
0
1 ( 33.3)
0
0
0
0
0
0
1 ( 33.3)
0
1 ( 33.3)
19 ( 33.9)
5 ( 8.9)
5 ( 8.9)
4 ( 7.1)
24 ( 42.9)
9 ( 16.1)
6 ( 10.7)
4 ( 7.1)
16 ( 28.6)
8 ( 14.3)
5 ( 8.9)
4 ( 7.1)
3 ( 5.4)
14 ( 25.0)
4 ( 7.1)
12 ( 21.4)
9 ( 16.1)
4 ( 7.1)
8 ( 14.3)
6 ( 10.7)
9 ( 16.1)
3 ( 5.4)
0
0
1 ( 1.8)
2 ( 3.6)
0
1 ( 1.8)
0
5 ( 8.9)
4 ( 7.1)
0
1 ( 1.8)
0
2 ( 3.6)
0
1 ( 1.8)
0
1 ( 1.8)
3 ( 5.4)
1 ( 1.8)
0
20 ( 32.3)
5 ( 8.1)
5 ( 8.1)
4 ( 6.5)
26 ( 41.9)
9 ( 14.5)
6 ( 9.7)
5 ( 8.1)
18 ( 29.0)
8 ( 12.9)
5 ( 8.1)
5 ( 8.1)
4 ( 6.5)
15 ( 24.2)
5 ( 8.1)
13 ( 21.0)
9 ( 14.5)
5 ( 8.1)
10 ( 16.1)
7 ( 11.3)
10 ( 16.1)
3 ( 4.8)
0
0
1 ( 1.6)
2 ( 3.2)
0
1 ( 1.6)
0
6 ( 9.7)
4 ( 6.5)
0
2 ( 3.2)
0
2 ( 3.2)
0
1 ( 1.6)
0
1 ( 1.6)
4 ( 6.5)
1 ( 1.6)
1 ( 1.6)
0
0
0
0
0
0
1 ( 5.6)
2 ( 11.1)
0
0
0
0
5 ( 13.2)
7 ( 18.4)
4 ( 10.5)
0
0
0
0
0
0
0
0
0
6 ( 10.7)
9 ( 16.1)
4 ( 7.1)
0
0
0
6 ( 9.7)
9 ( 14.5)
4 ( 6.5)
0
0
0
本品の初回投与から 8 週間以内の死亡は目標用量 150×106 個で 1 例に認められた。死因は死亡で、
本品との因果関係は否定されなかった。本品の初回投与から 8 週間を超えて発現した有害事象によ
る死亡は、目標用量 150×106 個、450×106 個、800×106 個でそれぞれ 1 例、2 例、1 例に認められた。
死因は、目標用量 150×106 個で真菌感染が 1 例、目標用量 450×106 個で心肺停止及び多臓器機能不全
症候群が各 1 例、目標用量 800×106 個でムコール症が 1 例であった。いずれも本品との因果関係は否
定された。その他、病勢進行により目標用量 50×106 個、150×106 個、450×106 個、800×106 個でそれ
ぞれ 3 例、5 例、8 例、1 例が死亡した。
3.6.
国際共同第Ⅲ相試験(BB2121-MM-003 試験)
本試験で本品群に割り付けられ本品を投与された被験者 225 例において、投与後の有害事象及び
副作用は全例(100%)に認められた(データカットオフ日:2022 年 10 月 3 日)。全グレードの発
現割合が 5%以上の副作用は表 13 のとおりであった。
17