よむ、つかう、まなぶ。
総-3参考1○最適使用推進ガイドラインについて(報告) (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00257.html |
| 出典情報 | 中央社会保険医療協議会 総会(第590回 6/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
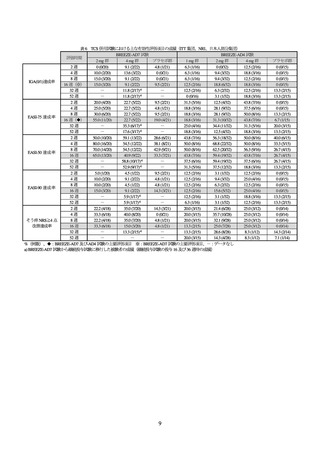
2)既存治療で効果不十分なアトピー性皮膚炎(小児)
国際共同第Ⅲ相試験(I4V-MC-JAIP〔BREEZE-AD-PEDS〕試験)
【試験の概要】
Moderate potency 以上の TCS5)等で効果不十分な中等症から重症の小児 AD 患者(目標例数 440 例
〔各群 110 例〕
)を対象に、TCS 等の併用下でのプラセボに対する本剤の有効性及び安全性を検討
するため、プラセボ対照無作為化二重盲検並行群間比較試験が日本、ポーランド、アルゼンチン等
の 17 の国又は地域で実施された。
本試験は、主に二重盲検期(投与 16 週まで)及び長期継続投与期(投与 16 週から投与 268 週)
より構成された。
二重盲検期の用法・用量は、本剤低用量、中用量若しくは高用量(表 7)又はプラセボを 1 日 1 回
経口投与することと設定された。
長期継続投与期の用法・用量は、二重盲検期における症状変化等によって異なり、二重盲検期に
救済治療6)を受けず、投与 16 週時に IGA スコアが 2 以下となった被験者(レスポンダー集団)は、
盲検下で二重盲検期と同一の用法・用量を継続することとされた。一方、二重盲検期に救済治療を
受けた若しくは投与 16 週時に IGA スコアが 2 以下とならなかった被験者、又は二重盲検期と同一
の用法・用量が継続され投与 16 週以降に IGA スコアが 3 又は 4 に悪化した被験者は、非盲検下で
本剤高用量を 1 日 1 回経口投与することとされた。
ベースラインの 14 日以上前から試験期間中を通して、保湿外用薬を連日併用することとされた。
また、スクリーニング7)時より規定された TCS 等の外用薬による治療8)を開始し、病勢が収束した時
点で漸減、中止することとされた。
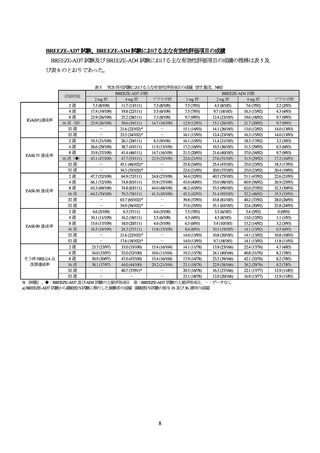
年齢(投与剤形)
2 歳以上 10 歳未満
(内用懸濁液)
10 歳以上 18 歳未満
(錠剤)
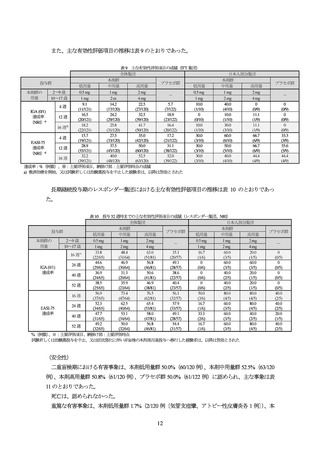
表 7 本剤投与群の用量
本剤低用量群
本剤中用量群
本剤高用量群
0.5 mg
1 mg
2 mg
1 mg
2 mg
4 mg
投与 16 週時の IGA (0/1)達成率が主要評価項目とされた。
対象となる患者は、2 歳以上 18 歳未満の AD 患者で、スクリーニング時に以下の基準を満たすこ
ととされた。
WHO の効力分類(WHO Model Prescribing Information: Drugs used in Skin Diseases. World Health Organization; 1997. p117-8)に基づき TCS
クラスを分類。国内 AD 診療ガイドラインに基づく分類では以下の薬剤が含まれる。
low potency:ウィークからミディアム/moderate potency:ミディアムからストロング/high potency:ミディアムからベリーストロン
グ/ultra high potency:ストロンゲスト
6)
治験責任(分担)医師の判断により、保湿剤及び low 又は moderate potency の TCS を併用しても病勢が継続又は悪化する場合には、
high 又は ultra high potency の TCS を使用することが許容された。また、high 又は ultra high potency の TCS を使用しても十分に反応
しない場合は治験薬投与を中止し、全身治療薬(既存の全身治療薬又は生物製剤)を投与することが可能とされた。
7)
スクリーニング来院がベースライン来院の 8~35 日前に設定された。
8)
スクリーニング来院時に、本邦からの被験者にはプレドニゾロンクリーム 0.5%(日本の分類ではウィーククラス、WHO 分類では
low potency)及びヒドロコルチゾン酪酸エステル軟膏 0.1%(日本の分類ではミディアムクラス、WHO 分類では moderate potency)
が治験依頼者から提供され、ベースライン時まで治験責任(分担)医師の指示に従い使用することとされた(外国の被験者に対して
も同程度の効力の TCS が提供された)
。
ベースライン以降は moderate potency の TCS を塗布することとされた。
皮膚の薄い部位
(顔、
頸部、間擦部、陰部等)及び皮膚萎縮のある部位には low potency の TCS、TCI 又は外用ホスホジエステラーゼ 4 阻害剤の使用が許
容された。
5)
10
国際共同第Ⅲ相試験(I4V-MC-JAIP〔BREEZE-AD-PEDS〕試験)
【試験の概要】
Moderate potency 以上の TCS5)等で効果不十分な中等症から重症の小児 AD 患者(目標例数 440 例
〔各群 110 例〕
)を対象に、TCS 等の併用下でのプラセボに対する本剤の有効性及び安全性を検討
するため、プラセボ対照無作為化二重盲検並行群間比較試験が日本、ポーランド、アルゼンチン等
の 17 の国又は地域で実施された。
本試験は、主に二重盲検期(投与 16 週まで)及び長期継続投与期(投与 16 週から投与 268 週)
より構成された。
二重盲検期の用法・用量は、本剤低用量、中用量若しくは高用量(表 7)又はプラセボを 1 日 1 回
経口投与することと設定された。
長期継続投与期の用法・用量は、二重盲検期における症状変化等によって異なり、二重盲検期に
救済治療6)を受けず、投与 16 週時に IGA スコアが 2 以下となった被験者(レスポンダー集団)は、
盲検下で二重盲検期と同一の用法・用量を継続することとされた。一方、二重盲検期に救済治療を
受けた若しくは投与 16 週時に IGA スコアが 2 以下とならなかった被験者、又は二重盲検期と同一
の用法・用量が継続され投与 16 週以降に IGA スコアが 3 又は 4 に悪化した被験者は、非盲検下で
本剤高用量を 1 日 1 回経口投与することとされた。
ベースラインの 14 日以上前から試験期間中を通して、保湿外用薬を連日併用することとされた。
また、スクリーニング7)時より規定された TCS 等の外用薬による治療8)を開始し、病勢が収束した時
点で漸減、中止することとされた。
年齢(投与剤形)
2 歳以上 10 歳未満
(内用懸濁液)
10 歳以上 18 歳未満
(錠剤)
表 7 本剤投与群の用量
本剤低用量群
本剤中用量群
本剤高用量群
0.5 mg
1 mg
2 mg
1 mg
2 mg
4 mg
投与 16 週時の IGA (0/1)達成率が主要評価項目とされた。
対象となる患者は、2 歳以上 18 歳未満の AD 患者で、スクリーニング時に以下の基準を満たすこ
ととされた。
WHO の効力分類(WHO Model Prescribing Information: Drugs used in Skin Diseases. World Health Organization; 1997. p117-8)に基づき TCS
クラスを分類。国内 AD 診療ガイドラインに基づく分類では以下の薬剤が含まれる。
low potency:ウィークからミディアム/moderate potency:ミディアムからストロング/high potency:ミディアムからベリーストロン
グ/ultra high potency:ストロンゲスト
6)
治験責任(分担)医師の判断により、保湿剤及び low 又は moderate potency の TCS を併用しても病勢が継続又は悪化する場合には、
high 又は ultra high potency の TCS を使用することが許容された。また、high 又は ultra high potency の TCS を使用しても十分に反応
しない場合は治験薬投与を中止し、全身治療薬(既存の全身治療薬又は生物製剤)を投与することが可能とされた。
7)
スクリーニング来院がベースライン来院の 8~35 日前に設定された。
8)
スクリーニング来院時に、本邦からの被験者にはプレドニゾロンクリーム 0.5%(日本の分類ではウィーククラス、WHO 分類では
low potency)及びヒドロコルチゾン酪酸エステル軟膏 0.1%(日本の分類ではミディアムクラス、WHO 分類では moderate potency)
が治験依頼者から提供され、ベースライン時まで治験責任(分担)医師の指示に従い使用することとされた(外国の被験者に対して
も同程度の効力の TCS が提供された)
。
ベースライン以降は moderate potency の TCS を塗布することとされた。
皮膚の薄い部位
(顔、
頸部、間擦部、陰部等)及び皮膚萎縮のある部位には low potency の TCS、TCI 又は外用ホスホジエステラーゼ 4 阻害剤の使用が許
容された。
5)
10