よむ、つかう、まなぶ。
総-3参考1○最適使用推進ガイドラインについて(報告) (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00257.html |
| 出典情報 | 中央社会保険医療協議会 総会(第590回 6/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
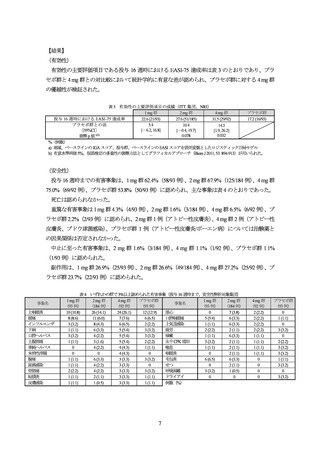
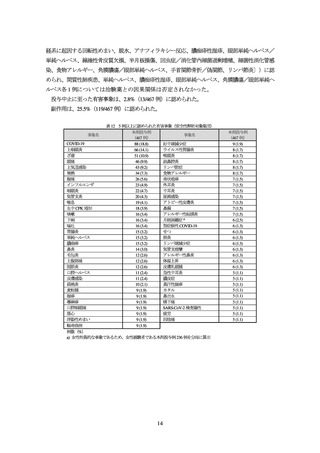
3. 臨床成績
1)既存治療で効果不十分なアトピー性皮膚炎(成人)及び 2)同(小児)の承認時に評価を行っ
た主な臨床試験の成績を示す。
1)既存治療で効果不十分なアトピー性皮膚炎(成人)
国際共同第Ⅲ相試験(BREEZE-AD7 試験)
【試験の概要】
Moderate potency(本邦における分類ではミディアム~ストロングクラスに相当する)以上のステ
ロイド外用薬(以下、
「TCS」
)で効果不十分な中等症から重症の AD 患者(目標例数 300 例〔各群
100 例〕
)を対象に、TCS 併用下での本剤の有効性及び安全性を検討するため、プラセボ対照無作為
化二重盲検並行群間比較試験が日本、韓国、ドイツ等、10 の国又は地域で実施された。
用法・用量は、本剤 2 mg、4 mg1)又はプラセボを 1 日 1 回 16 週間経口投与することと設定され
た。ベースラインの 2 週間(外用治療薬)又は 4 週間(全身治療薬)前から保湿外用薬を除く AD
治療薬を中止することとされ、14 日以上前から試験期間を通して保湿外用薬を併用することとされ
た。また、ベースライン時より TCS 治療を開始し、病勢が収束した場合には中止することとされ2)、
耐え難い症状が発現した場合には、投与 2 週時以降に救済治療3)が許容された。
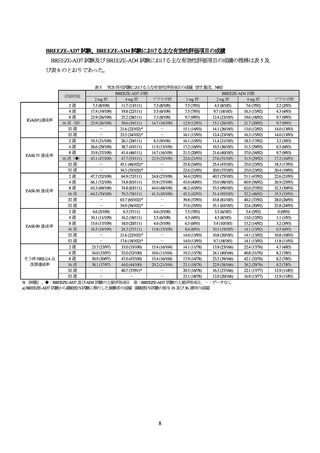
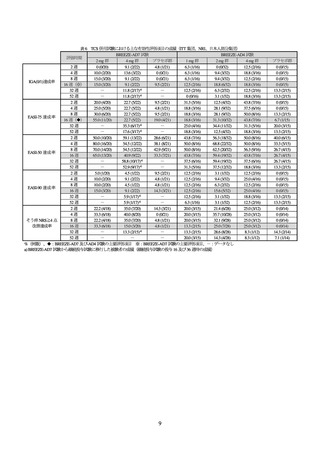
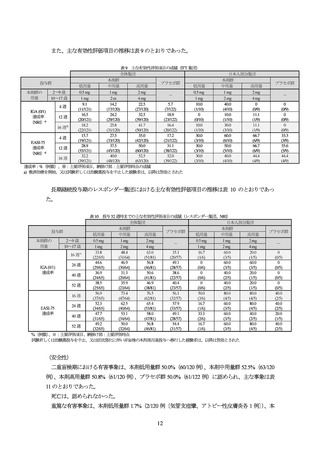
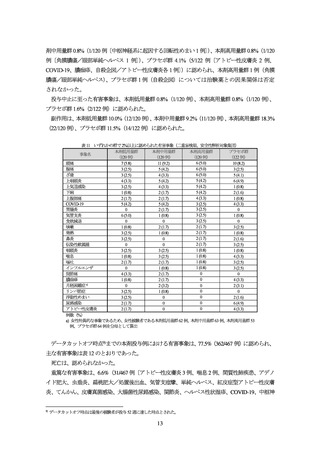
投与 16 週後の医師による全般評価スコアが 1 以下かつベースラインから 2 以上減少した被験者
の割合(IGA(0/1)達成率)及び全身の皮膚症状をスコア化した EASI スコアがベースラインから 75%
以上改善した被験者の割合(EASI-75 達成率)が co-primary endpoint とされた。
対象となる患者は 18 歳以上の AD 患者で、スクリーニング時に以下の基準を満たすこととされ
た。
(主な選択基準)
➢
米国皮膚科学会によるガイドラインに基づき 12 カ月以上前に AD と診断
➢
IGA スコア 3 以上、EASI スコア 16 以上、体表面積に占める AD 病変の割合 10%以上
➢
6 カ月以内に TCS で効果不十分である旨の記録がある:TCS で効果不十分とは、Moderate
potency 以上の TCS(必要に応じてカルシニューリン阻害外用薬〔以下、
「TCI」
〕を追加)を 4
週間又は添付文書で推奨される最長期間のいずれか短い方の期間使用しても、疾患をコントロ
ール(例:IGA スコア 2 以下)できない、又は AD に対する全身性治療で効果不十分であるこ
とと定義された。
4 mg 群に割り付けられた被験者のうち、腎機能障害(40≦eGFR<60 mL/分/1.73 m2)を有する被験者には 2 mg が投与された。
皮膚炎の活動性が高い部位に対してトリアムシノロン0.1%クリーム(又は同程度の効力の TCS、本邦の分類ではミディアム~スト
ロングクラスに相当する)を 1 日 1 回使用し、病勢が収束した後にヒドロコルチゾン 2.5%軟膏(又は同程度の効力の TCS、本邦に
おける分類ではウィーク~ミディアムクラスに相当する)に切り替え 1 日 1 回 7 日間使用後、中止することとされた。再燃した場
合は、トリアムシノロン 0.1%クリーム(又は同程度の効力の TCS)又はヒドロコルチゾン 2.5%軟膏(又は同程度の効力の TCS)を
再開することとされた。これらの TCS で軽快しない場合は、High potency(本邦の分類ではストロング~ベリーストロングクラスに
相当する)以上の TCS による救済治療を検討することとされた。
3)
High potency 以上の TCS より開始し、十分に反応しない場合は全身治療薬(経口ステロイド薬又は全身性非ステロイド性免疫抑制
薬)の投与が可能とされたが、全身治療薬を使用した場合には、以降の試験期間における治験薬の投与は中止された。
1)
2)
4
1)既存治療で効果不十分なアトピー性皮膚炎(成人)及び 2)同(小児)の承認時に評価を行っ
た主な臨床試験の成績を示す。
1)既存治療で効果不十分なアトピー性皮膚炎(成人)
国際共同第Ⅲ相試験(BREEZE-AD7 試験)
【試験の概要】
Moderate potency(本邦における分類ではミディアム~ストロングクラスに相当する)以上のステ
ロイド外用薬(以下、
「TCS」
)で効果不十分な中等症から重症の AD 患者(目標例数 300 例〔各群
100 例〕
)を対象に、TCS 併用下での本剤の有効性及び安全性を検討するため、プラセボ対照無作為
化二重盲検並行群間比較試験が日本、韓国、ドイツ等、10 の国又は地域で実施された。
用法・用量は、本剤 2 mg、4 mg1)又はプラセボを 1 日 1 回 16 週間経口投与することと設定され
た。ベースラインの 2 週間(外用治療薬)又は 4 週間(全身治療薬)前から保湿外用薬を除く AD
治療薬を中止することとされ、14 日以上前から試験期間を通して保湿外用薬を併用することとされ
た。また、ベースライン時より TCS 治療を開始し、病勢が収束した場合には中止することとされ2)、
耐え難い症状が発現した場合には、投与 2 週時以降に救済治療3)が許容された。
投与 16 週後の医師による全般評価スコアが 1 以下かつベースラインから 2 以上減少した被験者
の割合(IGA(0/1)達成率)及び全身の皮膚症状をスコア化した EASI スコアがベースラインから 75%
以上改善した被験者の割合(EASI-75 達成率)が co-primary endpoint とされた。
対象となる患者は 18 歳以上の AD 患者で、スクリーニング時に以下の基準を満たすこととされ
た。
(主な選択基準)
➢
米国皮膚科学会によるガイドラインに基づき 12 カ月以上前に AD と診断
➢
IGA スコア 3 以上、EASI スコア 16 以上、体表面積に占める AD 病変の割合 10%以上
➢
6 カ月以内に TCS で効果不十分である旨の記録がある:TCS で効果不十分とは、Moderate
potency 以上の TCS(必要に応じてカルシニューリン阻害外用薬〔以下、
「TCI」
〕を追加)を 4
週間又は添付文書で推奨される最長期間のいずれか短い方の期間使用しても、疾患をコントロ
ール(例:IGA スコア 2 以下)できない、又は AD に対する全身性治療で効果不十分であるこ
とと定義された。
4 mg 群に割り付けられた被験者のうち、腎機能障害(40≦eGFR<60 mL/分/1.73 m2)を有する被験者には 2 mg が投与された。
皮膚炎の活動性が高い部位に対してトリアムシノロン0.1%クリーム(又は同程度の効力の TCS、本邦の分類ではミディアム~スト
ロングクラスに相当する)を 1 日 1 回使用し、病勢が収束した後にヒドロコルチゾン 2.5%軟膏(又は同程度の効力の TCS、本邦に
おける分類ではウィーク~ミディアムクラスに相当する)に切り替え 1 日 1 回 7 日間使用後、中止することとされた。再燃した場
合は、トリアムシノロン 0.1%クリーム(又は同程度の効力の TCS)又はヒドロコルチゾン 2.5%軟膏(又は同程度の効力の TCS)を
再開することとされた。これらの TCS で軽快しない場合は、High potency(本邦の分類ではストロング~ベリーストロングクラスに
相当する)以上の TCS による救済治療を検討することとされた。
3)
High potency 以上の TCS より開始し、十分に反応しない場合は全身治療薬(経口ステロイド薬又は全身性非ステロイド性免疫抑制
薬)の投与が可能とされたが、全身治療薬を使用した場合には、以降の試験期間における治験薬の投与は中止された。
1)
2)
4