よむ、つかう、まなぶ。
【参考資料5】海外で臨床開発が先行した医薬品の国際共同治験開始前の日本人での第Ⅰ相試験の実施に関する基本的考え方について (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41120.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第16回 7/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
第16回 医薬品等行政評価・監視委員会
令和6年7月4日
医薬薬審発 1225 第2号
令和5年 12 月 25 日
各都道府県衛生主管部(局)長
殿
厚生労働省医薬局医薬品審査管理課長
(
公
印
省
略
)
海外で臨床開発が先行した医薬品の国際共同治験開始前の
日本人での第Ⅰ相試験の実施に関する基本的考え方について
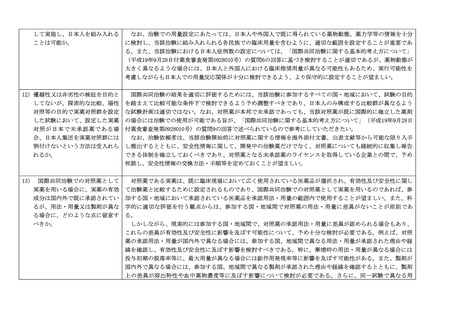
国際共同治験開始前の日本人での第Ⅰ相試験の実施に関する考え方について
は、これまで、
「国際共同治験に関する基本的考え方について」(平成 19 年9月
28 日付け薬食審査発第 0928010 号厚生労働省医薬食品局審査管理課長通知)、
「「国際共同治験に関する基本的考え方(参考事例)」について」(平成 24 年9
月5日付け厚生労働省医薬食品局審査管理課事務連絡)及び「国際共同治験開
始前の日本人での第Ⅰ相試験の実施に関する基本的考え方について」(平成 26
年 10 月 27 日付け厚生労働省医薬食品局審査管理課事務連絡。以下「旧事務連
絡」という。
)により示してきたところです。
近年、海外の新興バイオ医薬品企業が初期開発を行う革新的な医薬品を中心
として、海外で先行して早期の臨床開発が進められ、その後の検証的な国際共
同治験の実施が間近に迫った段階において日本の参加が検討されるケースが増
加するなど、創薬環境の変化が指摘されています。また、このようなケースに
おいて、国際共同治験への日本人の参加の可否がその後の日本での当該医薬品
の導入に大きく影響します。今般、このような創薬環境の変化等を踏まえ、国
際共同治験に参加する日本人の安全性を確保するとともに、革新的な医薬品の
導入が日本で遅れることによる患者の不利益を最小化する観点から、「国際共
同治験に関する基本的考え方」の 3.を削除し、「国際共同治験に関する基本的
考え方(参考事例)」を別添1の新旧対照表のとおり改正し、旧事務連絡を廃
止するとともに、海外で臨床開発が先行した医薬品の国際共同治験開始前の日
本人での第Ⅰ相試験の実施に関する基本的考え方について別添2のとおりとり
まとめましたので、御了知の上、貴管内関係事業者に対し周知方御協力お願い
いたします。
なお、別添2の英訳及び改正後の国際共同治験に関する基本的考え方(参考
事例)を参考として添付します。また、本通知の写しについて、別記の団体等
に宛てて連絡するので、念のため申し添えます。
参考資料5
令和6年7月4日
医薬薬審発 1225 第2号
令和5年 12 月 25 日
各都道府県衛生主管部(局)長
殿
厚生労働省医薬局医薬品審査管理課長
(
公
印
省
略
)
海外で臨床開発が先行した医薬品の国際共同治験開始前の
日本人での第Ⅰ相試験の実施に関する基本的考え方について
国際共同治験開始前の日本人での第Ⅰ相試験の実施に関する考え方について
は、これまで、
「国際共同治験に関する基本的考え方について」(平成 19 年9月
28 日付け薬食審査発第 0928010 号厚生労働省医薬食品局審査管理課長通知)、
「「国際共同治験に関する基本的考え方(参考事例)」について」(平成 24 年9
月5日付け厚生労働省医薬食品局審査管理課事務連絡)及び「国際共同治験開
始前の日本人での第Ⅰ相試験の実施に関する基本的考え方について」(平成 26
年 10 月 27 日付け厚生労働省医薬食品局審査管理課事務連絡。以下「旧事務連
絡」という。
)により示してきたところです。
近年、海外の新興バイオ医薬品企業が初期開発を行う革新的な医薬品を中心
として、海外で先行して早期の臨床開発が進められ、その後の検証的な国際共
同治験の実施が間近に迫った段階において日本の参加が検討されるケースが増
加するなど、創薬環境の変化が指摘されています。また、このようなケースに
おいて、国際共同治験への日本人の参加の可否がその後の日本での当該医薬品
の導入に大きく影響します。今般、このような創薬環境の変化等を踏まえ、国
際共同治験に参加する日本人の安全性を確保するとともに、革新的な医薬品の
導入が日本で遅れることによる患者の不利益を最小化する観点から、「国際共
同治験に関する基本的考え方」の 3.を削除し、「国際共同治験に関する基本的
考え方(参考事例)」を別添1の新旧対照表のとおり改正し、旧事務連絡を廃
止するとともに、海外で臨床開発が先行した医薬品の国際共同治験開始前の日
本人での第Ⅰ相試験の実施に関する基本的考え方について別添2のとおりとり
まとめましたので、御了知の上、貴管内関係事業者に対し周知方御協力お願い
いたします。
なお、別添2の英訳及び改正後の国際共同治験に関する基本的考え方(参考
事例)を参考として添付します。また、本通知の写しについて、別記の団体等
に宛てて連絡するので、念のため申し添えます。
参考資料5