よむ、つかう、まなぶ。
【参考資料5】海外で臨床開発が先行した医薬品の国際共同治験開始前の日本人での第Ⅰ相試験の実施に関する基本的考え方について (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41120.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第16回 7/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
参考2
国際共同治験に関する基本的考え方(参考事例)
平成 24 年 9 月5日作成
令和3年 12 月 10 日改正
令和5年 12 月 25 日改正
(独)医薬品医療機器総合機構
はじめに
我が国が参加する国際共同治験の経験は、平成 19 年に「国際共同治験に関する基本的考え方について」(平成 19 年 9 月 28 日付薬食審査発第 0928010 号、
厚生労働省医薬食品局審査管理課長通知)が通知されてから着実に増加しており、近年では、欧米との国際共同治験だけでなく、日中韓等の東アジア地域
での国際共同治験も増加している。また、我が国と海外との連携内容も、開発の初期段階からの国際共同治験の実施や数千例を超える大規模国際共同治験
への参加等多様化しつつある。さらに、規制当局間においても、日米欧だけでなく日中韓 3 カ国の連携も強化されつつあり、医薬品の国際開発が進む中で、
国際共同治験、特に東アジア地域における国際共同治験が円滑かつ適切に実施されることは、得られた結果の評価を行う規制当局にとっても重要な課題で
ある。
このような状況を踏まえ、既発出の「国際共同治験に関する基本的考え方について」の理解をさらに深め、我が国がより早い段階から国際開発に円滑に
参加するとともに、今後も増加が予想される東アジア地域における国際共同治験等の円滑かつ適切な実施に資することを目的に、今般、近年の事例を踏ま
えて、国際共同治験に関する基本的考え方(参考事例)を取りまとめることとした。
以下にその内容を示すが、これらは一般的な事例を示したものであり、個々のケースについては、(独)医薬品医療機器総合機構(以下、「 PMDA」とい
う。
)との対面助言において相談することが推奨される。
なお、これら事例は、現時点における科学的知見に基づいて述べたものであり、今後の状況の変化、科学技術の進歩や知見の集積等に応じて随時見直さ
れ、改訂されるべきものであることに留意する必要がある。
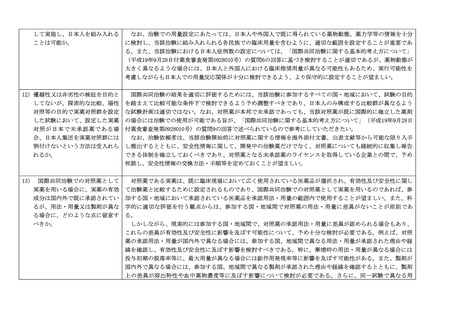
1.東アジア地域での国際共同治験に関する留意事項
1) 東アジア地域で国際共同治験を実
日中韓等の東アジア地域の民族間では、代謝酵素における遺伝子多型の種類と頻度あるいは遺伝子プロファイル
施するにあたって特に留意する事
が類似していると考えられ、近年では、東アジア地域での国際共同治験を主たる臨床試験結果として承認された医
項はあるか。
薬品もある。したがって、十分な検討に基づき計画され、実施された東アジア地域での国際共同治験の結果を、本
邦での承認申請資料として受け入れることは可能である。
しかしながら、東アジア民族間においても民族的要因(内因性民族的要因のみならず、医療習慣や社会経済的要
因等の外因性民族的要因も重要)の差異が、医薬品の有効性及び安全性(データそのものだけではなく、評価に及
国際共同治験に関する基本的考え方(参考事例)
平成 24 年 9 月5日作成
令和3年 12 月 10 日改正
令和5年 12 月 25 日改正
(独)医薬品医療機器総合機構
はじめに
我が国が参加する国際共同治験の経験は、平成 19 年に「国際共同治験に関する基本的考え方について」(平成 19 年 9 月 28 日付薬食審査発第 0928010 号、
厚生労働省医薬食品局審査管理課長通知)が通知されてから着実に増加しており、近年では、欧米との国際共同治験だけでなく、日中韓等の東アジア地域
での国際共同治験も増加している。また、我が国と海外との連携内容も、開発の初期段階からの国際共同治験の実施や数千例を超える大規模国際共同治験
への参加等多様化しつつある。さらに、規制当局間においても、日米欧だけでなく日中韓 3 カ国の連携も強化されつつあり、医薬品の国際開発が進む中で、
国際共同治験、特に東アジア地域における国際共同治験が円滑かつ適切に実施されることは、得られた結果の評価を行う規制当局にとっても重要な課題で
ある。
このような状況を踏まえ、既発出の「国際共同治験に関する基本的考え方について」の理解をさらに深め、我が国がより早い段階から国際開発に円滑に
参加するとともに、今後も増加が予想される東アジア地域における国際共同治験等の円滑かつ適切な実施に資することを目的に、今般、近年の事例を踏ま
えて、国際共同治験に関する基本的考え方(参考事例)を取りまとめることとした。
以下にその内容を示すが、これらは一般的な事例を示したものであり、個々のケースについては、(独)医薬品医療機器総合機構(以下、「 PMDA」とい
う。
)との対面助言において相談することが推奨される。
なお、これら事例は、現時点における科学的知見に基づいて述べたものであり、今後の状況の変化、科学技術の進歩や知見の集積等に応じて随時見直さ
れ、改訂されるべきものであることに留意する必要がある。
1.東アジア地域での国際共同治験に関する留意事項
1) 東アジア地域で国際共同治験を実
日中韓等の東アジア地域の民族間では、代謝酵素における遺伝子多型の種類と頻度あるいは遺伝子プロファイル
施するにあたって特に留意する事
が類似していると考えられ、近年では、東アジア地域での国際共同治験を主たる臨床試験結果として承認された医
項はあるか。
薬品もある。したがって、十分な検討に基づき計画され、実施された東アジア地域での国際共同治験の結果を、本
邦での承認申請資料として受け入れることは可能である。
しかしながら、東アジア民族間においても民族的要因(内因性民族的要因のみならず、医療習慣や社会経済的要
因等の外因性民族的要因も重要)の差異が、医薬品の有効性及び安全性(データそのものだけではなく、評価に及