よむ、つかう、まなぶ。
【参考資料5】海外で臨床開発が先行した医薬品の国際共同治験開始前の日本人での第Ⅰ相試験の実施に関する基本的考え方について (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41120.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第16回 7/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
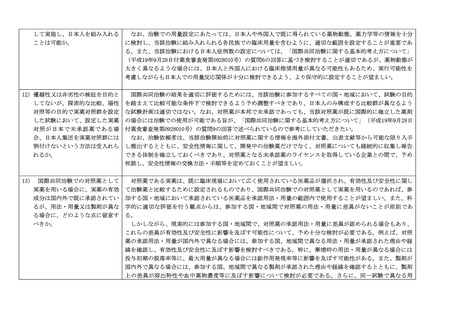
して実施し、日本人を組み入れる
ことは可能か。
なお、治験での用量設定にあたっては、日本人や外国人で既に得られている薬物動態、薬力学等の情報を十分
に検討し、当該治験に組み入れられる各民族での臨床用量を含むように、適切な範囲を設定することが重要であ
る。また、当該治験における日本人症例数の設定については、「国際共同治験に関する基本的考え方について」
(平成19年9月28日付薬食審査発第0928010号)の質問6の回答に基づき検討することが適切であるが、薬物動態が
大きく異なるような場合には、日本人と外国人における臨床推奨用量が異なる可能性もあるため、実行可能性を
考慮しながらも日本人での用量反応関係が十分に検討できるよう、より保守的に設定することが望ましい。
12)優越性又は非劣性の検証を目的と
国際共同治験の結果を適切に評価するためには、当該治験に参加するすべての国・地域において、試験の目的
してないが、探索的な比較、陽性
を踏まえて比較可能な条件下で検討できるよう予め調整すべきであり、日本人のみ構成する比較群が異なるよう
対照等の目的で実薬対照群を設定
な試験計画は適切ではない。なお、対照薬が本邦で未承認であっても、当該対照薬が既に国際的に確立した薬剤
した試験において、設定した実薬
の場合には治験での使用が可能である旨が、「国際共同治験に関する基本的考え方について」(平成19年9月28日
対照が日本で未承認薬である場
付薬食審査発第0928010号)の質問9の回答で述べられているので参考にしていただきたい。
合、日本人集団を実薬対照群には
なお、治験依頼者は、当該治験開始前に対照薬に関する情報を海外添付文書、公表文献等から可能な限り入手
割付けないという方法は受入れら
し提出するとともに、安全性情報に関して、開発中の治験薬だけでなく、対照薬についても継続的に収集し報告
れるか。
できる体制を確立しておくべきであり、対照薬となる未承認薬のライセンスを取得している企業との間で、予め
相談し、安全性情報の交換方法・手順等を定めておくことが望ましい。
13) 国際共同治験での対照薬として
対照薬である実薬は、既に臨床現場において広く使用されている医薬品が選択され、有効性及び安全性に関し
実薬を用いる場合に、実薬の有効
て治験薬と比較するために設定されるものであり、国際共同治験での対照薬として実薬を用いるのであれば、参
成分は国内外で既に承認されてい
加する国・地域において承認されている医薬品を承認用法・用量の範囲内で使用することが望ましい。また、科
るが、用法・用量又は製剤が異な
学的に適切な評価を行う観点からは、参加する国・地域間で対照薬の用法・用量に差異がないことが原則であ
る場合に、どのような点に留意す
る。
べきか。
しかしながら、現実的には参加する国・地域間で、対照薬の承認用法・用量に差異が認められる場合もあり、
これらの差異が有効性及び安全性に影響を及ぼす可能性について、予め十分な検討が必要である。例えば、対照
薬の承認用法・用量が国内外で異なる場合には、参加する国、地域間で異なる用法・用量が承認された理由や経
緯を確認し、有効性及び安全性に及ぼす影響を検討すべきである。特に、漸増時の用法・用量が異なる場合には
投与初期の脱落率等に、最大用量が異なる場合には副作用発現率等に影響を及ぼす可能性がある。また、製剤が
国内外で異なる場合には、参加する国、地域間で異なる製剤が承認された理由や経緯を確認するとともに、製剤
上の差異が溶出特性や血中薬物濃度等に及ぼす影響について検討が必要である。さらに、同一試験で異なる用
ことは可能か。
なお、治験での用量設定にあたっては、日本人や外国人で既に得られている薬物動態、薬力学等の情報を十分
に検討し、当該治験に組み入れられる各民族での臨床用量を含むように、適切な範囲を設定することが重要であ
る。また、当該治験における日本人症例数の設定については、「国際共同治験に関する基本的考え方について」
(平成19年9月28日付薬食審査発第0928010号)の質問6の回答に基づき検討することが適切であるが、薬物動態が
大きく異なるような場合には、日本人と外国人における臨床推奨用量が異なる可能性もあるため、実行可能性を
考慮しながらも日本人での用量反応関係が十分に検討できるよう、より保守的に設定することが望ましい。
12)優越性又は非劣性の検証を目的と
国際共同治験の結果を適切に評価するためには、当該治験に参加するすべての国・地域において、試験の目的
してないが、探索的な比較、陽性
を踏まえて比較可能な条件下で検討できるよう予め調整すべきであり、日本人のみ構成する比較群が異なるよう
対照等の目的で実薬対照群を設定
な試験計画は適切ではない。なお、対照薬が本邦で未承認であっても、当該対照薬が既に国際的に確立した薬剤
した試験において、設定した実薬
の場合には治験での使用が可能である旨が、「国際共同治験に関する基本的考え方について」(平成19年9月28日
対照が日本で未承認薬である場
付薬食審査発第0928010号)の質問9の回答で述べられているので参考にしていただきたい。
合、日本人集団を実薬対照群には
なお、治験依頼者は、当該治験開始前に対照薬に関する情報を海外添付文書、公表文献等から可能な限り入手
割付けないという方法は受入れら
し提出するとともに、安全性情報に関して、開発中の治験薬だけでなく、対照薬についても継続的に収集し報告
れるか。
できる体制を確立しておくべきであり、対照薬となる未承認薬のライセンスを取得している企業との間で、予め
相談し、安全性情報の交換方法・手順等を定めておくことが望ましい。
13) 国際共同治験での対照薬として
対照薬である実薬は、既に臨床現場において広く使用されている医薬品が選択され、有効性及び安全性に関し
実薬を用いる場合に、実薬の有効
て治験薬と比較するために設定されるものであり、国際共同治験での対照薬として実薬を用いるのであれば、参
成分は国内外で既に承認されてい
加する国・地域において承認されている医薬品を承認用法・用量の範囲内で使用することが望ましい。また、科
るが、用法・用量又は製剤が異な
学的に適切な評価を行う観点からは、参加する国・地域間で対照薬の用法・用量に差異がないことが原則であ
る場合に、どのような点に留意す
る。
べきか。
しかしながら、現実的には参加する国・地域間で、対照薬の承認用法・用量に差異が認められる場合もあり、
これらの差異が有効性及び安全性に影響を及ぼす可能性について、予め十分な検討が必要である。例えば、対照
薬の承認用法・用量が国内外で異なる場合には、参加する国、地域間で異なる用法・用量が承認された理由や経
緯を確認し、有効性及び安全性に及ぼす影響を検討すべきである。特に、漸増時の用法・用量が異なる場合には
投与初期の脱落率等に、最大用量が異なる場合には副作用発現率等に影響を及ぼす可能性がある。また、製剤が
国内外で異なる場合には、参加する国、地域間で異なる製剤が承認された理由や経緯を確認するとともに、製剤
上の差異が溶出特性や血中薬物濃度等に及ぼす影響について検討が必要である。さらに、同一試験で異なる用