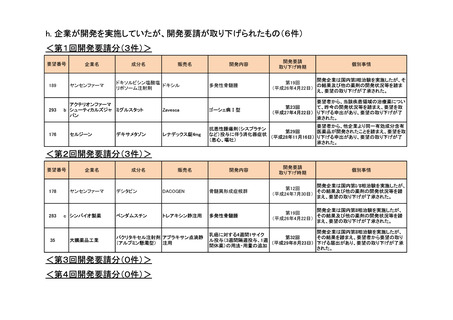
よむ、つかう、まなぶ。
資料4-3 企業から提出された開発工程表の概要等(第I回要望) (23 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00034.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第60回 9/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
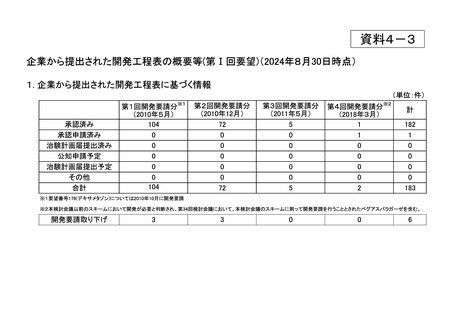
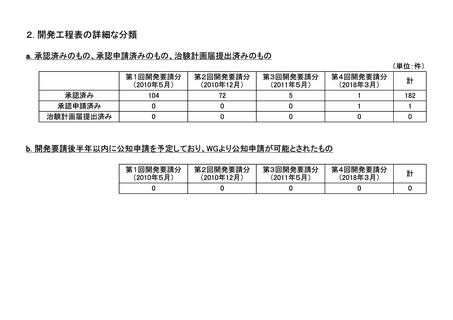
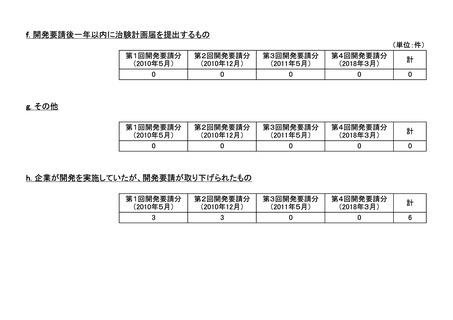
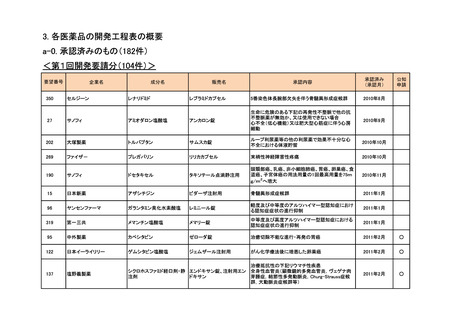
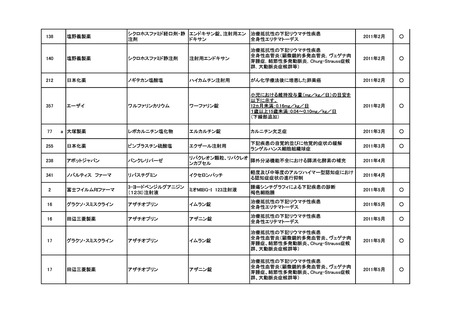
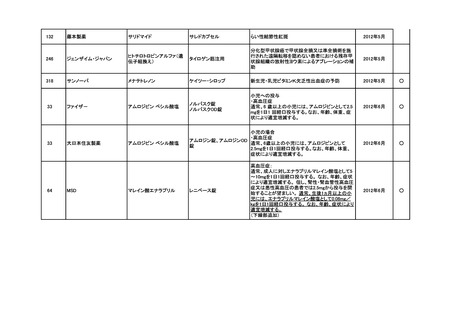
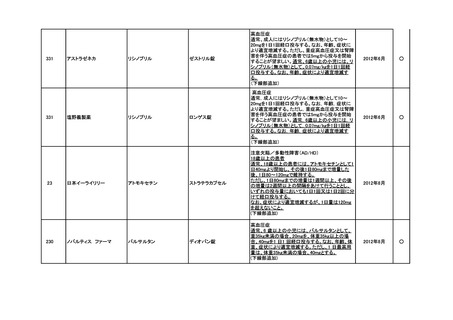
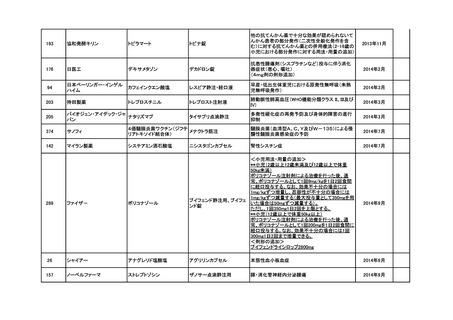
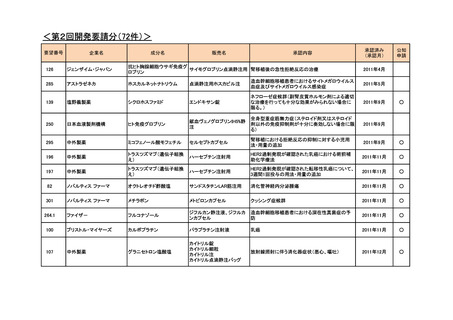
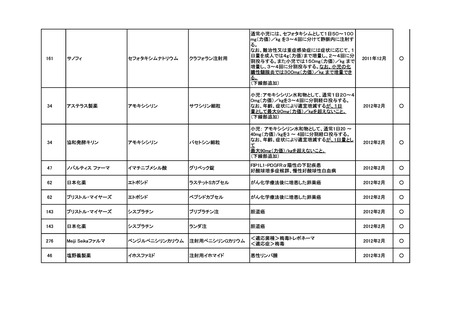
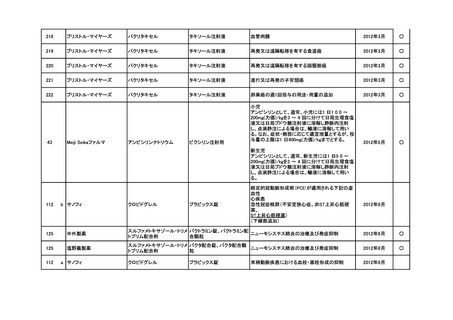
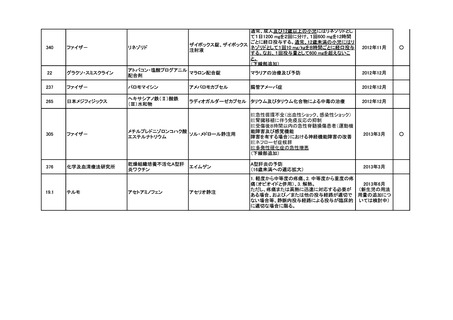
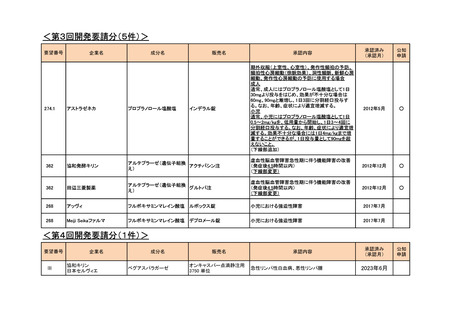
<第3回開発要請分(5件)>
要望番号
企業名
成分名
販売名
インデラル錠
承認内容
承認済み
(承認月)
公知
申請
期外収縮(上室性、心室性)、発作性頻拍の予防、
頻拍性心房細動(徐脈効果)、洞性頻脈、新鮮心房
細動、発作性心房細動の予防に使用する場合
成人
通常、成人にはプロプラノロール塩酸塩として1日
30mgより投与をはじめ、効果が不十分な場合は
60mg、90mgと漸増し、1日3回に分割経口投与す
る。なお、年齢、症状により適宜増減する。
小児
通常、小児にはプロプラノロール塩酸塩として1日
0.5~2mg/kgを、低用量から開始し、1日3~4回に
分割経口投与する。なお、年齢、症状により適宜増
減する。効果不十分な場合には1日4mg/kgまで増
量することができるが、1日投与量として90mgを超
えないこと。
(下線部追加)
2012年5月
○
274.1
アストラゼネカ
プロプラノロール塩酸塩
362
協和発酵キリン
アルテプラーゼ(遺伝子組換
アクチバシン注
え)
虚血性脳血管障害急性期に伴う機能障害の改善
(発症後4.5時間以内)
(下線部変更)
2012年12月
○
362
田辺三菱製薬
アルテプラーゼ(遺伝子組換
グルトパ注
え)
虚血性脳血管障害急性期に伴う機能障害の改善
(発症後4.5時間以内)
(下線部変更)
2012年12月
○
268
アッヴィ
フルボキサミンマレイン酸塩 ルボックス錠
小児における強迫性障害
2017年7月
268
Meiji Seikaファルマ
フルボキサミンマレイン酸塩 デプロメール錠
小児における強迫性障害
2017年7月
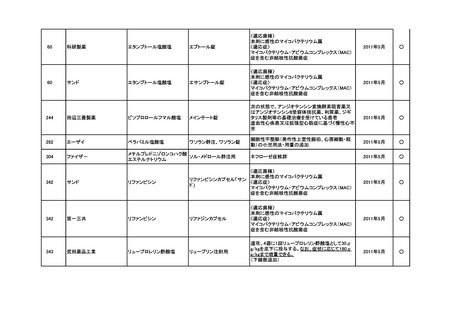
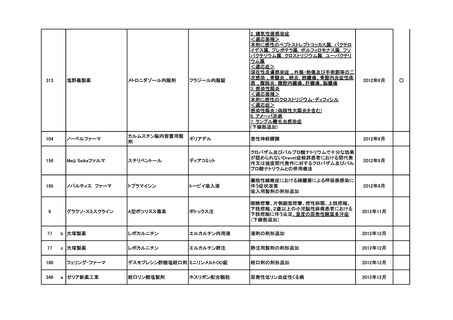
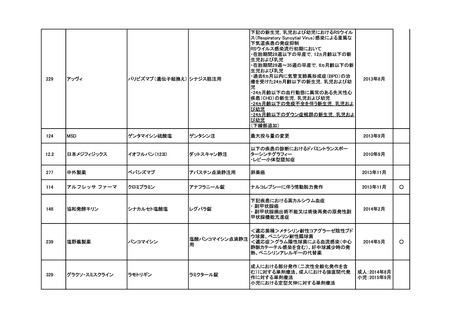
<第4回開発要請分(1件)>
要望番号
※
企業名
協和キリン
日本セルヴィエ
成分名
ペグアスパラガーゼ
販売名
オンキャスパー点滴静注用
3750 単位
承認内容
急性リンパ性白血病、悪性リンパ腫
承認済み
(承認月)
2023年6月
公知
申請
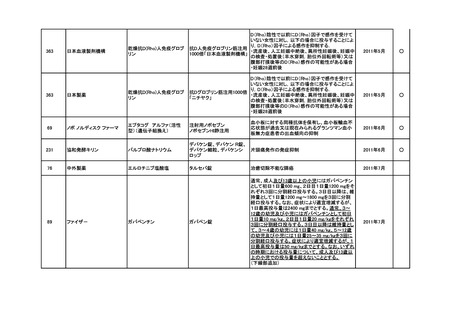
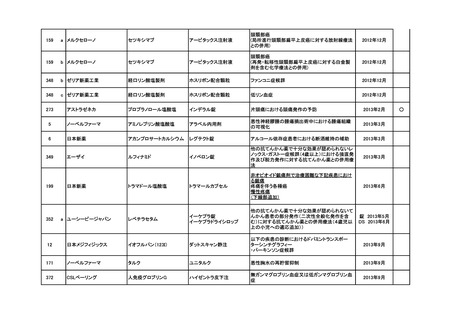
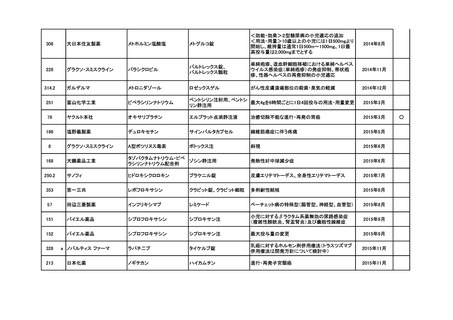
要望番号
企業名
成分名
販売名
インデラル錠
承認内容
承認済み
(承認月)
公知
申請
期外収縮(上室性、心室性)、発作性頻拍の予防、
頻拍性心房細動(徐脈効果)、洞性頻脈、新鮮心房
細動、発作性心房細動の予防に使用する場合
成人
通常、成人にはプロプラノロール塩酸塩として1日
30mgより投与をはじめ、効果が不十分な場合は
60mg、90mgと漸増し、1日3回に分割経口投与す
る。なお、年齢、症状により適宜増減する。
小児
通常、小児にはプロプラノロール塩酸塩として1日
0.5~2mg/kgを、低用量から開始し、1日3~4回に
分割経口投与する。なお、年齢、症状により適宜増
減する。効果不十分な場合には1日4mg/kgまで増
量することができるが、1日投与量として90mgを超
えないこと。
(下線部追加)
2012年5月
○
274.1
アストラゼネカ
プロプラノロール塩酸塩
362
協和発酵キリン
アルテプラーゼ(遺伝子組換
アクチバシン注
え)
虚血性脳血管障害急性期に伴う機能障害の改善
(発症後4.5時間以内)
(下線部変更)
2012年12月
○
362
田辺三菱製薬
アルテプラーゼ(遺伝子組換
グルトパ注
え)
虚血性脳血管障害急性期に伴う機能障害の改善
(発症後4.5時間以内)
(下線部変更)
2012年12月
○
268
アッヴィ
フルボキサミンマレイン酸塩 ルボックス錠
小児における強迫性障害
2017年7月
268
Meiji Seikaファルマ
フルボキサミンマレイン酸塩 デプロメール錠
小児における強迫性障害
2017年7月
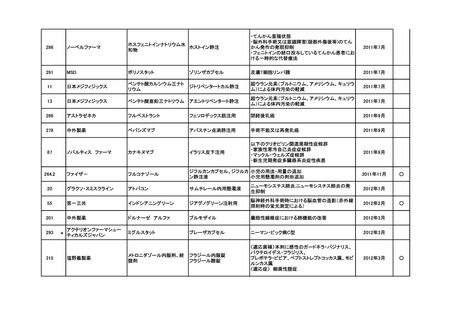
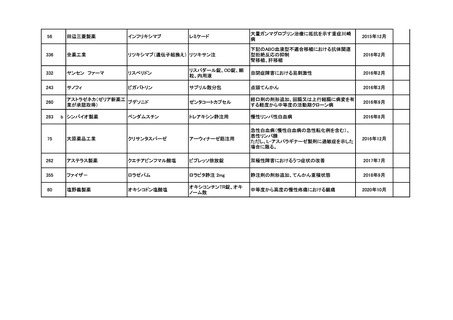
<第4回開発要請分(1件)>
要望番号
※
企業名
協和キリン
日本セルヴィエ
成分名
ペグアスパラガーゼ
販売名
オンキャスパー点滴静注用
3750 単位
承認内容
急性リンパ性白血病、悪性リンパ腫
承認済み
(承認月)
2023年6月
公知
申請