よむ、つかう、まなぶ。
【参考資料】これまでの議論で出された主な意見.pdf (13 ページ)
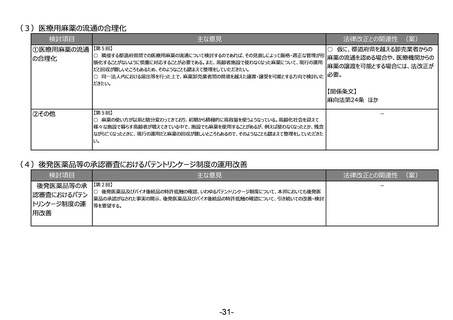
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44072.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第7回 10/3)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
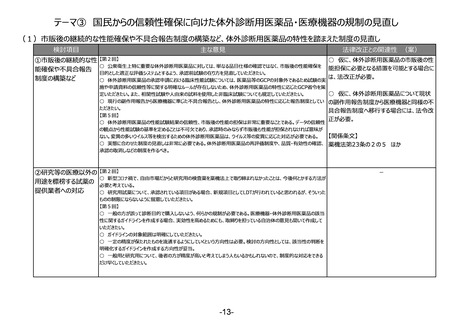
テーマ③ 国民からの信頼性確保に向けた体外診断用医薬品・医療機器の規制の見直し
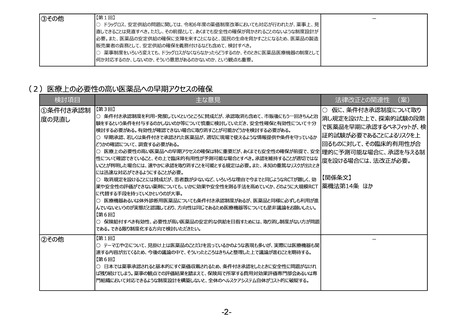
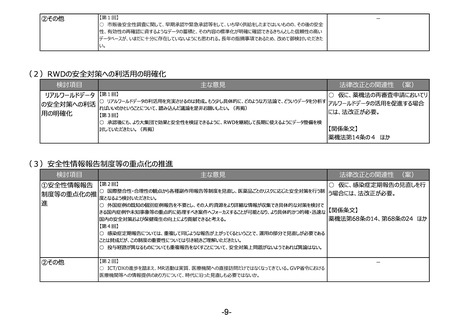
(1)市販後の継続的な性能確保や不具合報告制度の構築など、体外診断用医薬品の特性を踏まえた制度の見直し
検討項目
主な意見
法律改正との関連性 (案)
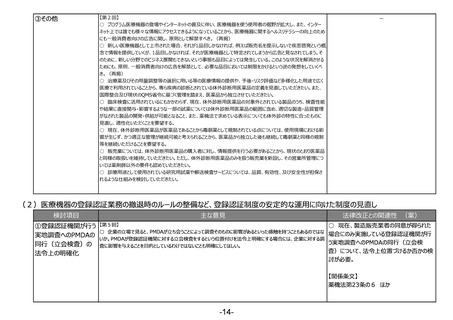
○ 仮に、体外診断用医薬品の市販後の性
①市販後の継続的な性 【第2回】
○ 公衆衛生上特に重要な体外診断用医薬品に対しては、単なる品目仕様の確認ではなく、市販後の性能確保を
能担保に必要となる措置を可能とする場合に
能確保や不具合報告
目的とした適正な評価システムとするよう、承認前試験の在り方を見直していただきたい。
は、法改正が必要。
制度の構築など
○ 体外診断用医薬品の承認申請における臨床性能試験については、医薬品等のGCPの対象外であるため試験の実
施や申請資料の信頼性等に関する明確なルールが存在しないため、体外診断用医薬品の特性に応じたGCP省令を策
○ 仮に、体外診断用医薬品について現状
定いただきたい。また、相関性試験や人由来の試料を使用した非臨床試験についても規定していただきたい。
○ 現行の副作用報告から医療機器に準じた不具合報告とし、体外診断用医薬品の特性に応じた報告制度としてい の副作用報告制度から医療機器と同様の不
ただきたい。
具合報告制度へ移行する場合には、法令改
【第5回】
正が必要。
○ 体外診断用医薬品の性能試験結果の信頼性、市販後の性能の担保は非常に重要なことである。データの信頼性
の観点から性能試験の基準を定めることは不可欠であり、承認時のみならず市販後も性能が担保されなければ意味が
【関係条文】
ない。変異の多いウイルス等を検出するための体外診断用医薬品は、ウイルス等の変異に応じた対応が必要である。
○ 実態に合わせた制度の見直しは非常に必要である。体外診断用医薬品の再評価制度や、品質・有効性の確認、 薬機法第23条の2の5 ほか
承認の取消しなどの制度を作るべき。
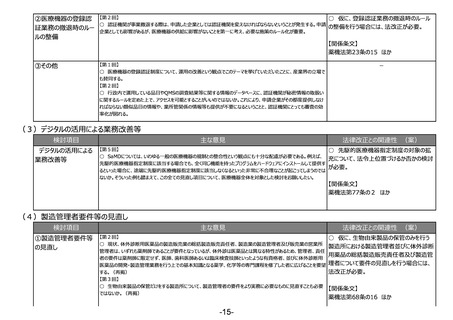
②研究等の医療以外の 【第2回】
○ 新型コロナ禍で、自由市場だからと研究用の検査薬を薬機法上で取り締まれなかったことは、今後何とかする方法が
用途を標榜する試薬の
必要と考えている。
提供業者への対応
○ 研究用試薬について、承認されている項目がある場合、新規項目としてLDTが行われていると思われるが、そういった
ものの制限にならないように留意していただきたい。
【第5回】
○ 一般の方が誤って診断目的で購入しないよう、何らかの規制が必要である。医療機器・体外診断用医薬品の該当
性に関するガイドラインを作成する場合、実効性を高めるためにも、取締りを担っている自治体の意見も聞いて作成して
いただきたい。
○ ガイドラインの対象範囲は明確にしていただきたい。
○ 一定の精度が保たれたものを流通するようにしていくという方向性は必要。検討の方向性としては、該当性の判断を
明確化するガイドラインを作成する方向性が妥当。
○ 一般用と研究用について、後者の方が精度が高いと考えてしまう人もいるかもしれないので、制度的な対応をできる
だけ早くしていただきたい。
-13-
-
(1)市販後の継続的な性能確保や不具合報告制度の構築など、体外診断用医薬品の特性を踏まえた制度の見直し
検討項目
主な意見
法律改正との関連性 (案)
○ 仮に、体外診断用医薬品の市販後の性
①市販後の継続的な性 【第2回】
○ 公衆衛生上特に重要な体外診断用医薬品に対しては、単なる品目仕様の確認ではなく、市販後の性能確保を
能担保に必要となる措置を可能とする場合に
能確保や不具合報告
目的とした適正な評価システムとするよう、承認前試験の在り方を見直していただきたい。
は、法改正が必要。
制度の構築など
○ 体外診断用医薬品の承認申請における臨床性能試験については、医薬品等のGCPの対象外であるため試験の実
施や申請資料の信頼性等に関する明確なルールが存在しないため、体外診断用医薬品の特性に応じたGCP省令を策
○ 仮に、体外診断用医薬品について現状
定いただきたい。また、相関性試験や人由来の試料を使用した非臨床試験についても規定していただきたい。
○ 現行の副作用報告から医療機器に準じた不具合報告とし、体外診断用医薬品の特性に応じた報告制度としてい の副作用報告制度から医療機器と同様の不
ただきたい。
具合報告制度へ移行する場合には、法令改
【第5回】
正が必要。
○ 体外診断用医薬品の性能試験結果の信頼性、市販後の性能の担保は非常に重要なことである。データの信頼性
の観点から性能試験の基準を定めることは不可欠であり、承認時のみならず市販後も性能が担保されなければ意味が
【関係条文】
ない。変異の多いウイルス等を検出するための体外診断用医薬品は、ウイルス等の変異に応じた対応が必要である。
○ 実態に合わせた制度の見直しは非常に必要である。体外診断用医薬品の再評価制度や、品質・有効性の確認、 薬機法第23条の2の5 ほか
承認の取消しなどの制度を作るべき。
②研究等の医療以外の 【第2回】
○ 新型コロナ禍で、自由市場だからと研究用の検査薬を薬機法上で取り締まれなかったことは、今後何とかする方法が
用途を標榜する試薬の
必要と考えている。
提供業者への対応
○ 研究用試薬について、承認されている項目がある場合、新規項目としてLDTが行われていると思われるが、そういった
ものの制限にならないように留意していただきたい。
【第5回】
○ 一般の方が誤って診断目的で購入しないよう、何らかの規制が必要である。医療機器・体外診断用医薬品の該当
性に関するガイドラインを作成する場合、実効性を高めるためにも、取締りを担っている自治体の意見も聞いて作成して
いただきたい。
○ ガイドラインの対象範囲は明確にしていただきたい。
○ 一定の精度が保たれたものを流通するようにしていくという方向性は必要。検討の方向性としては、該当性の判断を
明確化するガイドラインを作成する方向性が妥当。
○ 一般用と研究用について、後者の方が精度が高いと考えてしまう人もいるかもしれないので、制度的な対応をできる
だけ早くしていただきたい。
-13-
-