よむ、つかう、まなぶ。
【参考資料】これまでの議論で出された主な意見.pdf (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44072.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第7回 10/3)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
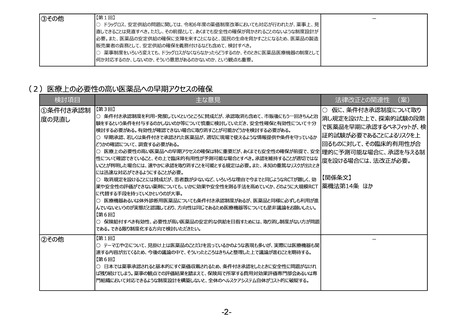
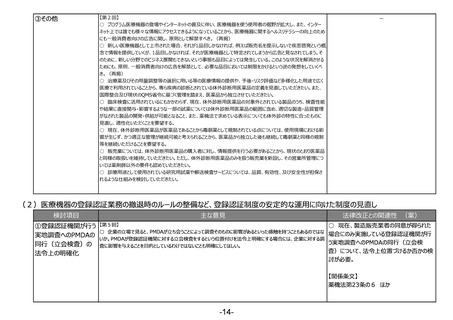
○ 薬剤師としての職能だけではなく、むしろ薬剤師に限らず、その時点できちんとした要件を担保しているということを基
本的には確保するべきなのではないか。
○ 業界としても、薬剤師を基本とすることに変わりはないと思っているが、薬剤師という要件、すなわちそういった技術的
知識に加えて、実務経験や品質問題に関して責任役員等にもきちんと意見を言える立場が必要と考えている。一方
で、製造所で製造しているものに対する適切な技術知識を持っている、例えば、バイオであれば発酵工学、原薬の製造
工場ならプロセス化学といった専門の技術を持っている者にも範囲を広げていただき、かつ実務経験で縛るということも御
検討いただきたい。この点の詳細な要件、また、時期等について御協議いただきたい。
【第6回】
○ 体外診断薬をどう考えるかが非常に重要。各論点の中で製造管理者の要件の見直しがテーマ①とテーマ③の2か
所あり、議論すべき内容の前提が違っていると思うので、この2つはきちんと別個の扱いをしていただき、どちらかの判断が
どちらかにそのまま影響してしまうことがないように慎重な議論をお願いしたい。
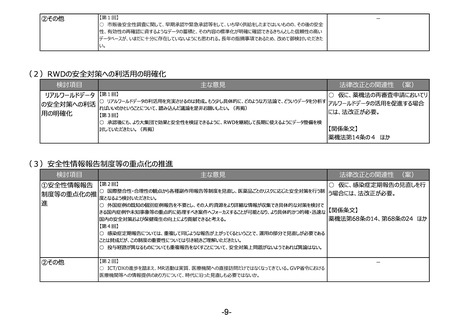
③その他
【第1回】
○ テーマ①や②について、見掛け上は医薬品のことだけを言っているかのような表現も多いが、実際には医療機器も関
連する内容が出てくるため、今後の議論の中で、そういったところはきちんと整理した上で議論が進むことを期待する。
(再掲)
【第3回】
○ 生物由来製品の保管だけをする製造所について、製造管理者の要件をより実務に必要なものに見直すことも必要
ではないか。
-
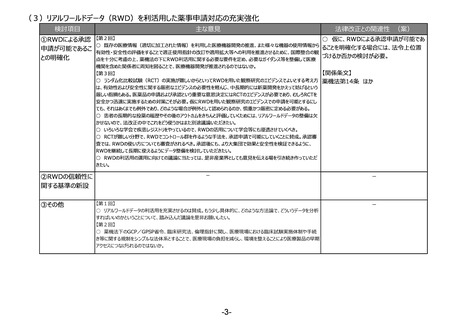
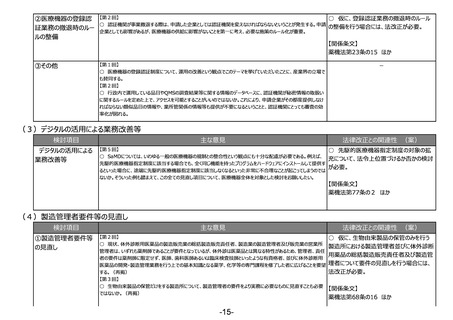
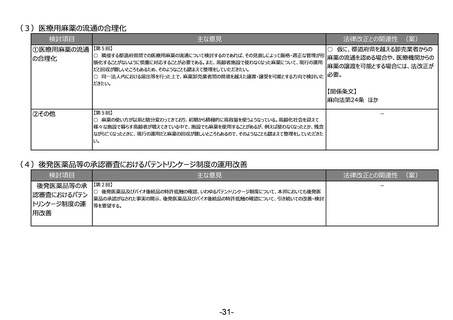
(6)適合性調査(GMP)の見直し
検討項目
①適合性調査
(GMP)の見直し
主な意見
法律改正との関連性 (案)
【第2回】
○ 仮に、より合理的なGMP調査制度に見
○ GMP適合性調査、GCP実地/書面適合性調査にリスクベースアプローチを取り入れ、工程や施設の重要度、調
直す場合には、法改正が必要。
査経験やリスク等の施設単位のプロファイリングを基に調査の内容・頻度を決定し、リスクの高い施設を重点的に調査す
る、国際的に整合性のある合理的制度への見直しを要望する。将来的に品目単位の調査から製造所単位の調査、
【関係条文】
そしてリスクベースによる調査への移行を引き続き検討いただきたい。
○ 国際的調和推進とグローバルサプライチェーンの効率化のため、製造所、製造工程ごとの基準確認証の利用範囲 薬機法第14条、第80条 ほか
を拡大し、製造所単位でのGMP管理を進めることを要望する。
○ 外国政府の管理監督下である海外製造所の手続を合理化し、重複した手続を不要とするよう要望する。
【第3回】
○ リスクが高いものに対して調査を重点的に行うという考え方自体は理解できるが、何をもってリスクを高いものと考える
かについては、薬品の性質による部分や製造事業者の体制による部分の両方あると思われるので、この辺りの基準が明
確になって、自分たちがどこを目指して、どのような調査を受ければいいのかが、双方に明確であることが大事。
○ 適合性調査(GMP)の見直しについて、適正に行われているかどうかをきちんとチェックし、それが担保できるような仕
組みを是非お願いしたい。
○ 査察のリソースが限られる中で、メリハリを付けて調査を行うことについては賛同する。リスク評価の方法など具体的
な運用方法については、各都道府県の意見や状況も考慮した上で、通知等でお示しいただきたい。
-6-
本的には確保するべきなのではないか。
○ 業界としても、薬剤師を基本とすることに変わりはないと思っているが、薬剤師という要件、すなわちそういった技術的
知識に加えて、実務経験や品質問題に関して責任役員等にもきちんと意見を言える立場が必要と考えている。一方
で、製造所で製造しているものに対する適切な技術知識を持っている、例えば、バイオであれば発酵工学、原薬の製造
工場ならプロセス化学といった専門の技術を持っている者にも範囲を広げていただき、かつ実務経験で縛るということも御
検討いただきたい。この点の詳細な要件、また、時期等について御協議いただきたい。
【第6回】
○ 体外診断薬をどう考えるかが非常に重要。各論点の中で製造管理者の要件の見直しがテーマ①とテーマ③の2か
所あり、議論すべき内容の前提が違っていると思うので、この2つはきちんと別個の扱いをしていただき、どちらかの判断が
どちらかにそのまま影響してしまうことがないように慎重な議論をお願いしたい。
③その他
【第1回】
○ テーマ①や②について、見掛け上は医薬品のことだけを言っているかのような表現も多いが、実際には医療機器も関
連する内容が出てくるため、今後の議論の中で、そういったところはきちんと整理した上で議論が進むことを期待する。
(再掲)
【第3回】
○ 生物由来製品の保管だけをする製造所について、製造管理者の要件をより実務に必要なものに見直すことも必要
ではないか。
-
(6)適合性調査(GMP)の見直し
検討項目
①適合性調査
(GMP)の見直し
主な意見
法律改正との関連性 (案)
【第2回】
○ 仮に、より合理的なGMP調査制度に見
○ GMP適合性調査、GCP実地/書面適合性調査にリスクベースアプローチを取り入れ、工程や施設の重要度、調
直す場合には、法改正が必要。
査経験やリスク等の施設単位のプロファイリングを基に調査の内容・頻度を決定し、リスクの高い施設を重点的に調査す
る、国際的に整合性のある合理的制度への見直しを要望する。将来的に品目単位の調査から製造所単位の調査、
【関係条文】
そしてリスクベースによる調査への移行を引き続き検討いただきたい。
○ 国際的調和推進とグローバルサプライチェーンの効率化のため、製造所、製造工程ごとの基準確認証の利用範囲 薬機法第14条、第80条 ほか
を拡大し、製造所単位でのGMP管理を進めることを要望する。
○ 外国政府の管理監督下である海外製造所の手続を合理化し、重複した手続を不要とするよう要望する。
【第3回】
○ リスクが高いものに対して調査を重点的に行うという考え方自体は理解できるが、何をもってリスクを高いものと考える
かについては、薬品の性質による部分や製造事業者の体制による部分の両方あると思われるので、この辺りの基準が明
確になって、自分たちがどこを目指して、どのような調査を受ければいいのかが、双方に明確であることが大事。
○ 適合性調査(GMP)の見直しについて、適正に行われているかどうかをきちんとチェックし、それが担保できるような仕
組みを是非お願いしたい。
○ 査察のリソースが限られる中で、メリハリを付けて調査を行うことについては賛同する。リスク評価の方法など具体的
な運用方法については、各都道府県の意見や状況も考慮した上で、通知等でお示しいただきたい。
-6-