よむ、つかう、まなぶ。
【参考資料】これまでの議論で出された主な意見.pdf (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44072.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第7回 10/3)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
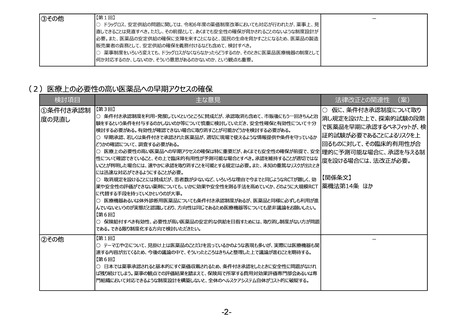
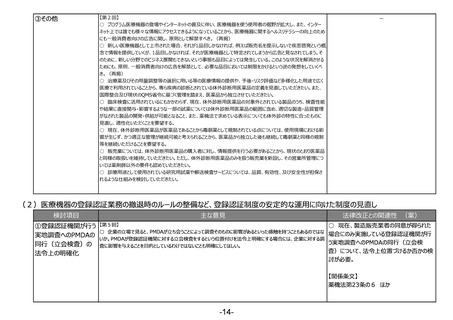
テーマ② 新技術による医薬品等にも対応したリスクに基づく市販後安全性対策の強化、
法違反事例を踏まえた更なる法令遵守や品質確保の取組の実施
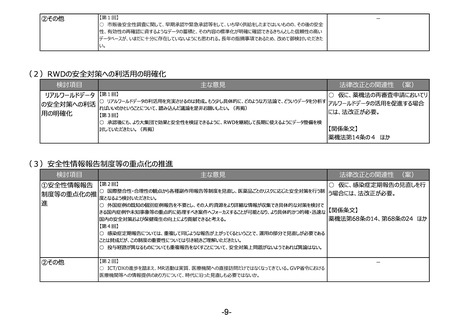
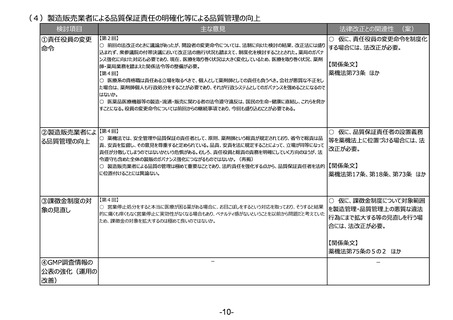
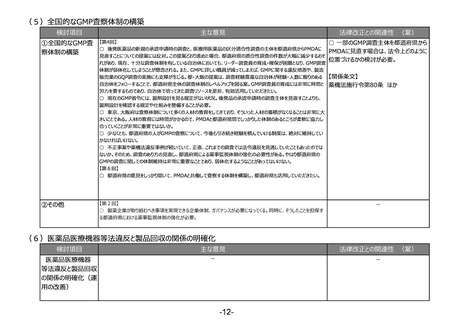
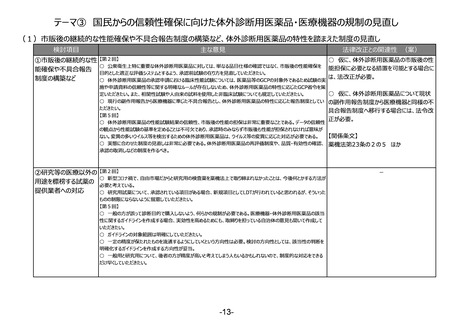
(1)リスクベースドアプローチの推進・RMP(医薬品リスク管理計画)制度の見直し
検討項目
①医薬品リスク管理
計画制度の見直し
主な意見
法律改正との関連性 (案)
【第1回】
○ 仮に、RMPの位置づけを法律上明確
○ 医薬品リスク管理計画については、計画を立てるところから患者の参加を求めるような議論をお願いしたい。
化するとともに、安全管理責任者の法的
○ 忙しい医療現場で市販後調査を行うということを前提に、誰がどれだけの仕事をしなければいけないのかということを整
位置づけを見直す場合には、法改正が必
理する必要があるため、その辺も含めて市販後調査、RMPの活用は実効性のある形になるような議論をしていただきた
い。医療現場で市販後の安全性を確認することが患者の利益にどれだけ寄与するのかということの理解を得て、それに対 要。
して一定程度の人的手当て等を国がするのか、または、企業にもっと必要な人員を割くべきと規制するのか、といった実効
性がある形で制度設計の議論をしていただきたい。
【関係条文】
○ テーマ①や②について、見掛け上は医薬品のことだけを言っているかのような表現も多いが、実際には医療機器も関
薬機法第11章 ほか
連する内容が出てくるため、今後の議論の中で、そういったところはきちんと整理した上で議論が進むことを期待する。(再
掲)
【第2回】
○ RMPの薬機法における法的位置付けを整理し、医薬品の開発段階・承認審査時から製造販売後までの全ての期
間においてリスクに応じた必要な安全対策を実施し、製造販売後の安全確保を図る制度となるよう要望する。
【第4回】
○ 医薬品はそもそも未知のリスクがあり、また既知のリスクも最少化させるため、市販後収集された情報に基づく安全対
策の実施は重要である。必要な場合に、RMPの策定や変更を行い、医薬品ライフサイクル全体を通じて安全対策が実
施されるよう見直すことで、実効性のある制度にしていただきたい。また、RMPの策定や変更に関する情報が、医療現場
に速やかに伝達されるようにお願いしたい。
○ RMP全体が承認条件となっていることも増えており、企業によって内容やそれに対する対応もばらつきが出ているた
め、見直しが必要であることには賛同する。ある程度形式化してしまっている部分もあるため、実践的安全対策にもっと
RMPが活用されるような制度にしていただきたい。
○ 今回、ドラッグラグ・ロスの解消と安定供給確保のため、国際整合性や合理性を含んだ要望を出した。事務局提案
の検討の方向性は、基本的には規制強化が示されていると理解している。医薬品においては十分なリスク管理、安定供
給においては十分な品質保証が前提となるので、この方向性で全般的に検討いただくことには異論はない。
○ 薬機法では、安全管理や品質保証の責任者として、原則、薬剤師という総責が規定されており、省令で総責は品
責、安責を監督し、その意見を尊重すると定められている。品責、安責を法に規定することによって、立場が同等になって
責任が分散してしまうのではないかという危惧がある。むしろ、責任役員と総責の責務を明確にしていく方向のほうが、法
令遵守も含めた全体の製販のガバナンス強化につながるものではないか。
○ 副作用報告等の収集件数がものすごく増加しており、収集ルートもインターネットや患者様の情報など媒体も非常に
多様化している。この機会に安責の役割、あるいは、例えば安全管理業務の委託、再委託等も含めて見直しを検討い
ただきたい。
○安全管理の責任者である安責に関しては、やはり市販後の安全対策や承認条件遵守が非常に重要であるが、未だ
に不満がある。安責が法律に位置づけられるという形式面だけではなく、今の時代に合った責任の在り方や、本当に機能
するかという観点で制度を考えていただきたい。
-8-
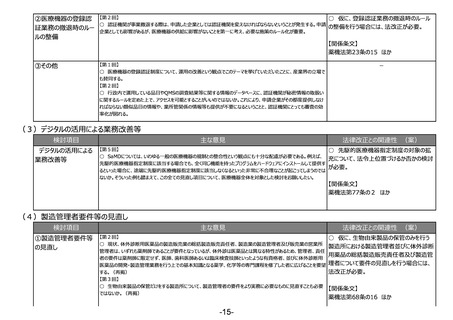
法違反事例を踏まえた更なる法令遵守や品質確保の取組の実施
(1)リスクベースドアプローチの推進・RMP(医薬品リスク管理計画)制度の見直し
検討項目
①医薬品リスク管理
計画制度の見直し
主な意見
法律改正との関連性 (案)
【第1回】
○ 仮に、RMPの位置づけを法律上明確
○ 医薬品リスク管理計画については、計画を立てるところから患者の参加を求めるような議論をお願いしたい。
化するとともに、安全管理責任者の法的
○ 忙しい医療現場で市販後調査を行うということを前提に、誰がどれだけの仕事をしなければいけないのかということを整
位置づけを見直す場合には、法改正が必
理する必要があるため、その辺も含めて市販後調査、RMPの活用は実効性のある形になるような議論をしていただきた
い。医療現場で市販後の安全性を確認することが患者の利益にどれだけ寄与するのかということの理解を得て、それに対 要。
して一定程度の人的手当て等を国がするのか、または、企業にもっと必要な人員を割くべきと規制するのか、といった実効
性がある形で制度設計の議論をしていただきたい。
【関係条文】
○ テーマ①や②について、見掛け上は医薬品のことだけを言っているかのような表現も多いが、実際には医療機器も関
薬機法第11章 ほか
連する内容が出てくるため、今後の議論の中で、そういったところはきちんと整理した上で議論が進むことを期待する。(再
掲)
【第2回】
○ RMPの薬機法における法的位置付けを整理し、医薬品の開発段階・承認審査時から製造販売後までの全ての期
間においてリスクに応じた必要な安全対策を実施し、製造販売後の安全確保を図る制度となるよう要望する。
【第4回】
○ 医薬品はそもそも未知のリスクがあり、また既知のリスクも最少化させるため、市販後収集された情報に基づく安全対
策の実施は重要である。必要な場合に、RMPの策定や変更を行い、医薬品ライフサイクル全体を通じて安全対策が実
施されるよう見直すことで、実効性のある制度にしていただきたい。また、RMPの策定や変更に関する情報が、医療現場
に速やかに伝達されるようにお願いしたい。
○ RMP全体が承認条件となっていることも増えており、企業によって内容やそれに対する対応もばらつきが出ているた
め、見直しが必要であることには賛同する。ある程度形式化してしまっている部分もあるため、実践的安全対策にもっと
RMPが活用されるような制度にしていただきたい。
○ 今回、ドラッグラグ・ロスの解消と安定供給確保のため、国際整合性や合理性を含んだ要望を出した。事務局提案
の検討の方向性は、基本的には規制強化が示されていると理解している。医薬品においては十分なリスク管理、安定供
給においては十分な品質保証が前提となるので、この方向性で全般的に検討いただくことには異論はない。
○ 薬機法では、安全管理や品質保証の責任者として、原則、薬剤師という総責が規定されており、省令で総責は品
責、安責を監督し、その意見を尊重すると定められている。品責、安責を法に規定することによって、立場が同等になって
責任が分散してしまうのではないかという危惧がある。むしろ、責任役員と総責の責務を明確にしていく方向のほうが、法
令遵守も含めた全体の製販のガバナンス強化につながるものではないか。
○ 副作用報告等の収集件数がものすごく増加しており、収集ルートもインターネットや患者様の情報など媒体も非常に
多様化している。この機会に安責の役割、あるいは、例えば安全管理業務の委託、再委託等も含めて見直しを検討い
ただきたい。
○安全管理の責任者である安責に関しては、やはり市販後の安全対策や承認条件遵守が非常に重要であるが、未だ
に不満がある。安責が法律に位置づけられるという形式面だけではなく、今の時代に合った責任の在り方や、本当に機能
するかという観点で制度を考えていただきたい。
-8-