よむ、つかう、まなぶ。
【参考資料】これまでの議論で出された主な意見.pdf (15 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44072.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第7回 10/3)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
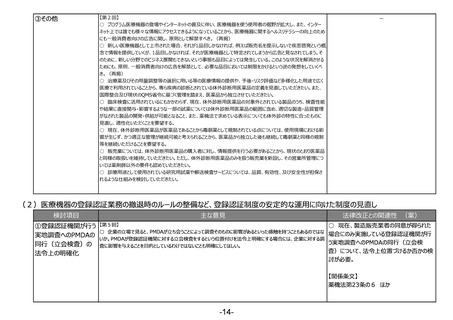
②医療機器の登録認
証業務の撤退時のルー
ルの整備
【第2回】
○ 仮に、登録認証業務の撤退時のルール
○ 認証機関が事業撤退する際は、申請した企業としては認証機関を変えなければならないということが発生する。申請
の整備を行う場合には、法改正が必要。
企業としても影響があるが、医療機器の供給に影響がないことを第一に考え、必要な施策のルール化が重要。
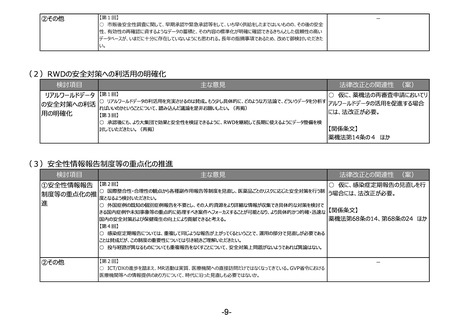
③その他
【第1回】
○ 医療機器の登録認証制度について、運用の改善という観点でこのテーマを挙げていただいたことに、産業界の立場で
も賛同する。
【第2回】
○ 行政内で運用している品目やQMSの調査結果等に関する情報のデータベースに、認証機関が秘密情報の取扱い
に関するルールを定めた上で、アクセスを可能とすることがいいのではないか。これにより、申請企業がその都度提供しなけ
ればならない類似品目の情報や、業所管関係の情報等も提供が不要になるということと、認証機関にとっても審査の効
率化が図れる。
【関係条文】
薬機法第23条の15 ほか
-
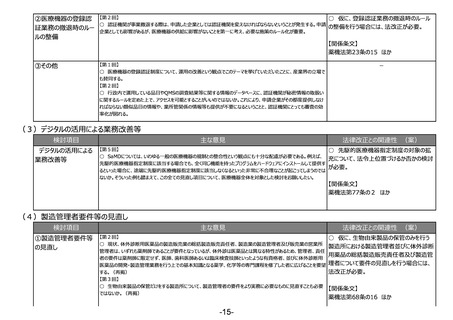
(3)デジタルの活用による業務改善等
検討項目
デジタルの活用による
業務改善等
主な意見
法律改正との関連性 (案)
【第5回】
○ 先駆的医療機器指定制度の対象の拡
○ SaMDについては、いわゆる一般の医療機器の規制との整合性という観点にも十分な配慮が必要である。例えば、
充について、法令上位置づけるか否かの検討
先駆的医療機器指定制度に該当する場合でも、全く同じ機能を持ったプログラムをハードウェアにインストールして提供す
が必要。
るといった場合に、途端に先駆的医療機器指定制度に該当しなくなるといった非常に不合理なことが起こってしまうのでは
ないか。そういった例も踏まえて、この全ての見直し項目について、医療機器全体を対象とした検討をお願いしたい。
【関係条文】
薬機法第77条の2 ほか
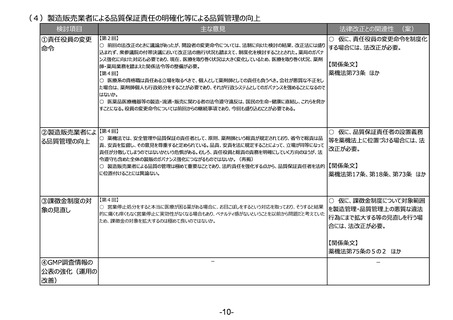
(4)製造管理者要件等の見直し
検討項目
①製造管理者要件等
の見直し
主な意見
法律改正との関連性 (案)
【第2回】
○ 仮に、生物由来製品の保管のみを行う
○ 現状、体外診断用医薬品の製造販売業の総括製造販売責任者、製造業の製造管理者及び販売業の営業所
製造所における製造管理者並びに体外診断
管理者は、いずれも薬剤師であることが要件となっているが、体外診は医薬品とは異なる特性があるため、管理者、責任
用薬品の総括製造販売責任者及び製造管
者の要件は薬剤師に限定せず、医師、歯科医師あるいは臨床検査技師といったような有資格者、並びに体外診断用
医薬品の開発・製造管理業務を行う上での基本知識となる薬学、化学等の専門課程を修了した者に広げることを要望 理者について要件の見直しを行う場合には、
法改正が必要。
する。(再掲)
【第3回】
○ 生物由来製品の保管だけをする製造所について、製造管理者の要件をより実務に必要なものに見直すことも必要
【関係条文】
ではないか。(再掲)
薬機法第68条の16 ほか
-15-
証業務の撤退時のルー
ルの整備
【第2回】
○ 仮に、登録認証業務の撤退時のルール
○ 認証機関が事業撤退する際は、申請した企業としては認証機関を変えなければならないということが発生する。申請
の整備を行う場合には、法改正が必要。
企業としても影響があるが、医療機器の供給に影響がないことを第一に考え、必要な施策のルール化が重要。
③その他
【第1回】
○ 医療機器の登録認証制度について、運用の改善という観点でこのテーマを挙げていただいたことに、産業界の立場で
も賛同する。
【第2回】
○ 行政内で運用している品目やQMSの調査結果等に関する情報のデータベースに、認証機関が秘密情報の取扱い
に関するルールを定めた上で、アクセスを可能とすることがいいのではないか。これにより、申請企業がその都度提供しなけ
ればならない類似品目の情報や、業所管関係の情報等も提供が不要になるということと、認証機関にとっても審査の効
率化が図れる。
【関係条文】
薬機法第23条の15 ほか
-
(3)デジタルの活用による業務改善等
検討項目
デジタルの活用による
業務改善等
主な意見
法律改正との関連性 (案)
【第5回】
○ 先駆的医療機器指定制度の対象の拡
○ SaMDについては、いわゆる一般の医療機器の規制との整合性という観点にも十分な配慮が必要である。例えば、
充について、法令上位置づけるか否かの検討
先駆的医療機器指定制度に該当する場合でも、全く同じ機能を持ったプログラムをハードウェアにインストールして提供す
が必要。
るといった場合に、途端に先駆的医療機器指定制度に該当しなくなるといった非常に不合理なことが起こってしまうのでは
ないか。そういった例も踏まえて、この全ての見直し項目について、医療機器全体を対象とした検討をお願いしたい。
【関係条文】
薬機法第77条の2 ほか
(4)製造管理者要件等の見直し
検討項目
①製造管理者要件等
の見直し
主な意見
法律改正との関連性 (案)
【第2回】
○ 仮に、生物由来製品の保管のみを行う
○ 現状、体外診断用医薬品の製造販売業の総括製造販売責任者、製造業の製造管理者及び販売業の営業所
製造所における製造管理者並びに体外診断
管理者は、いずれも薬剤師であることが要件となっているが、体外診は医薬品とは異なる特性があるため、管理者、責任
用薬品の総括製造販売責任者及び製造管
者の要件は薬剤師に限定せず、医師、歯科医師あるいは臨床検査技師といったような有資格者、並びに体外診断用
医薬品の開発・製造管理業務を行う上での基本知識となる薬学、化学等の専門課程を修了した者に広げることを要望 理者について要件の見直しを行う場合には、
法改正が必要。
する。(再掲)
【第3回】
○ 生物由来製品の保管だけをする製造所について、製造管理者の要件をより実務に必要なものに見直すことも必要
【関係条文】
ではないか。(再掲)
薬機法第68条の16 ほか
-15-