よむ、つかう、まなぶ。
【参考資料】これまでの議論で出された主な意見.pdf (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44072.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第7回 10/3)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
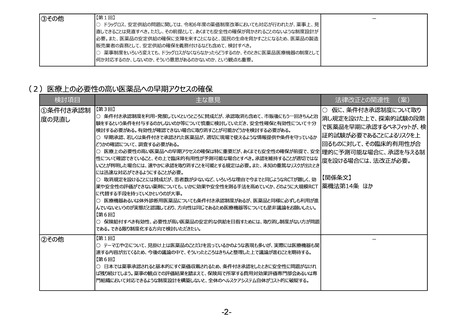
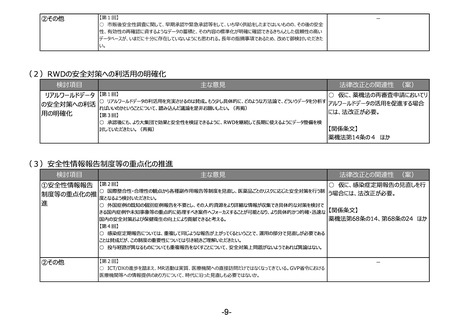
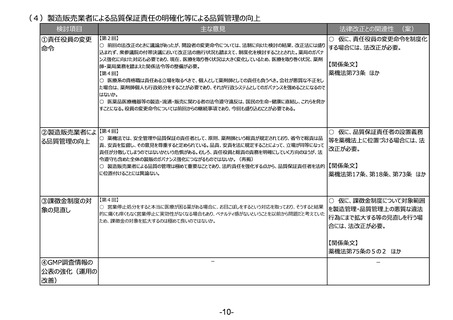
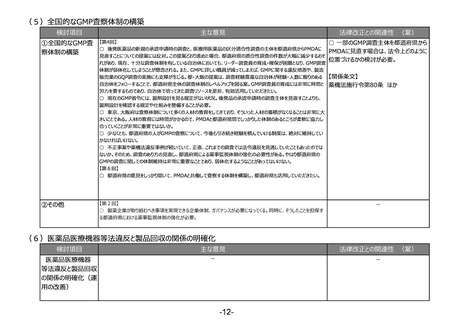
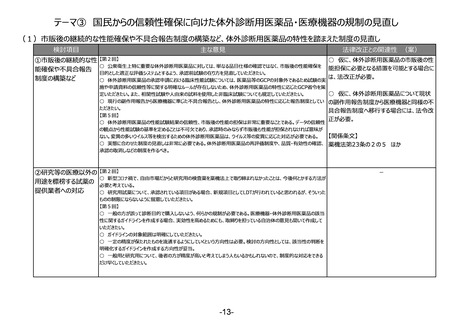
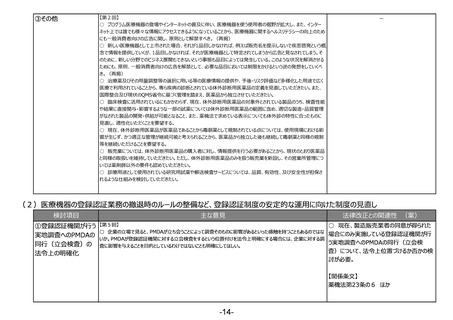
(4)医薬品等の供給不足を踏まえたアクセス改善に向けた制度の見直し
検討項目
主な意見
法律改正との関連性 (案)
①海外代替品等の
迅速な導入の仕組
み
【第2回】
○ 仮に、海外代替品等の迅速な導入の
○ 薬事申請資料の邦文記載条項や製造販売承認書で管理すべき事項の見直しも必要と考えている。
仕組みを設け、その表示の特例を設ける場
○ 日本薬局方、国家検定について、現在の薬機法下での製造販売承認の高い基準と照らし二重規制となっている
合には、法改正が必要。
点、国内独自のルールとなっている点や製造販売の禁止等については見直しが必要と考えている。
○ 日本薬局方の国際調和を考えて各条をこういう形にしましょうとする際に、業界の協力が得られれば、非常に先に
【関係条文】
進むことができると思っている。
【第3回】
薬機法第14条、第80条 ほか
○ 既承認医薬品が供給逼迫の際により医療上で著しい影響が生じる場合、海外で流通している代替品について、そ
の承認審査及び調査を優先かつ迅速に行うことができる規定をつくること、さらに該当品目について、海外で流通してい
る医薬品の包装のまま一定期間国内で流通できるようにする措置の両者とも異論はないが、前者はあくまでも期限付
き(temporary)であるべきで、恒常的にその医薬品の流通を認めることには、日本の医薬品の適正な品質確保の観
点から反対。
○ これまでも日本薬局方側から、国際調和を考え、業界に提案した事例は多数あるが、ほとんど業界側の協力が得
られないのが現状。日本薬局方の国際整合性を進めるためにも、業界側にも、必要な試資料やデータの提出等を念
頭とした、努力義務を課す制度を作ることが重要。
○ 海外の代替品の導入に関して、導入の規定を作ると同時に、国内の承認されている医薬品が供給できた時点で
中止する規定も必要なのではないか。
○ 海外の代替品等の迅速な導入の仕組みを整備することには賛成だが、審査等への影響を踏まえると、あくまでも供
給逼迫により著しい影響が生じる場合や医薬品とすべき。
○ 包装等については一定の特例を認めることは理解するが、あくまでもこの制度自体が期限付きであるべきであるとい
うことが前提で、国民・医療現場が混乱しないような対応をお願いしたい。
○ 日本薬局方の国際整合については、この機会に整理すべきところはすべきだが、あくまでも日本独自のもので必要な
もの、重要なものに関してはしっかり残すべき。
○ 日米欧の3極で、共通の制度を作っていくことが企業の負担軽減にもアクセスの改善にもなる。
○ 非常時の後発品の代替使用については、臨時、急変に対応するものなので限定的に行うことに賛成だが、例外的
な対応が漫然と続くことのないようにすべき。
②製造方法等の中
リスクの変更カテゴリ
の追加等
【第2回】
○ 仮に、製造方法等に係る中リスクの変更
○ 欧米に遅れることなく医薬品の製造方法等の変更・改良を行えるよう、短期間の確認で変更ができる中等度変更
カテゴリを設ける場合には、法改正が必要。
制度を新たな変更カテゴリーとして導入いただきたい。
③その他
【第3回】
○ 医療機器についても、安定供給の確保という観点で部材の変更あるいは製造所の変更といったところで医薬品とは
少し違う観点での変更が必要になってくるため、別途御相談、議論をさせていただきたい。
【関係条文】
薬機法第14条 ほか
-4-
-
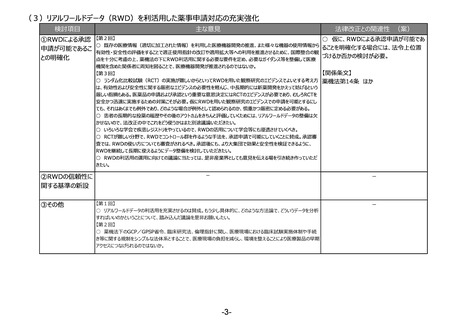
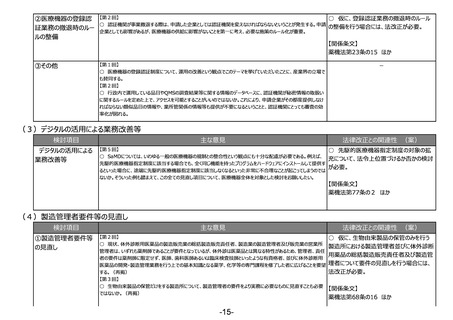
検討項目
主な意見
法律改正との関連性 (案)
①海外代替品等の
迅速な導入の仕組
み
【第2回】
○ 仮に、海外代替品等の迅速な導入の
○ 薬事申請資料の邦文記載条項や製造販売承認書で管理すべき事項の見直しも必要と考えている。
仕組みを設け、その表示の特例を設ける場
○ 日本薬局方、国家検定について、現在の薬機法下での製造販売承認の高い基準と照らし二重規制となっている
合には、法改正が必要。
点、国内独自のルールとなっている点や製造販売の禁止等については見直しが必要と考えている。
○ 日本薬局方の国際調和を考えて各条をこういう形にしましょうとする際に、業界の協力が得られれば、非常に先に
【関係条文】
進むことができると思っている。
【第3回】
薬機法第14条、第80条 ほか
○ 既承認医薬品が供給逼迫の際により医療上で著しい影響が生じる場合、海外で流通している代替品について、そ
の承認審査及び調査を優先かつ迅速に行うことができる規定をつくること、さらに該当品目について、海外で流通してい
る医薬品の包装のまま一定期間国内で流通できるようにする措置の両者とも異論はないが、前者はあくまでも期限付
き(temporary)であるべきで、恒常的にその医薬品の流通を認めることには、日本の医薬品の適正な品質確保の観
点から反対。
○ これまでも日本薬局方側から、国際調和を考え、業界に提案した事例は多数あるが、ほとんど業界側の協力が得
られないのが現状。日本薬局方の国際整合性を進めるためにも、業界側にも、必要な試資料やデータの提出等を念
頭とした、努力義務を課す制度を作ることが重要。
○ 海外の代替品の導入に関して、導入の規定を作ると同時に、国内の承認されている医薬品が供給できた時点で
中止する規定も必要なのではないか。
○ 海外の代替品等の迅速な導入の仕組みを整備することには賛成だが、審査等への影響を踏まえると、あくまでも供
給逼迫により著しい影響が生じる場合や医薬品とすべき。
○ 包装等については一定の特例を認めることは理解するが、あくまでもこの制度自体が期限付きであるべきであるとい
うことが前提で、国民・医療現場が混乱しないような対応をお願いしたい。
○ 日本薬局方の国際整合については、この機会に整理すべきところはすべきだが、あくまでも日本独自のもので必要な
もの、重要なものに関してはしっかり残すべき。
○ 日米欧の3極で、共通の制度を作っていくことが企業の負担軽減にもアクセスの改善にもなる。
○ 非常時の後発品の代替使用については、臨時、急変に対応するものなので限定的に行うことに賛成だが、例外的
な対応が漫然と続くことのないようにすべき。
②製造方法等の中
リスクの変更カテゴリ
の追加等
【第2回】
○ 仮に、製造方法等に係る中リスクの変更
○ 欧米に遅れることなく医薬品の製造方法等の変更・改良を行えるよう、短期間の確認で変更ができる中等度変更
カテゴリを設ける場合には、法改正が必要。
制度を新たな変更カテゴリーとして導入いただきたい。
③その他
【第3回】
○ 医療機器についても、安定供給の確保という観点で部材の変更あるいは製造所の変更といったところで医薬品とは
少し違う観点での変更が必要になってくるため、別途御相談、議論をさせていただきたい。
【関係条文】
薬機法第14条 ほか
-4-
-