よむ、つかう、まなぶ。
資料1 他の医療機関で製造されたPET製剤の使用に係る医療法上の取扱いについて (16 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_53987.html |
| 出典情報 | 医療放射線の適正管理に関する検討会(第4回 3/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
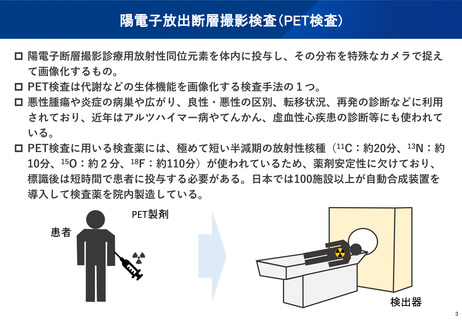
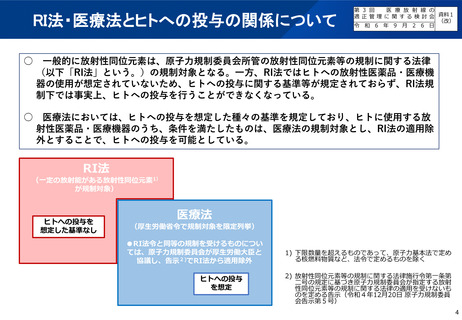
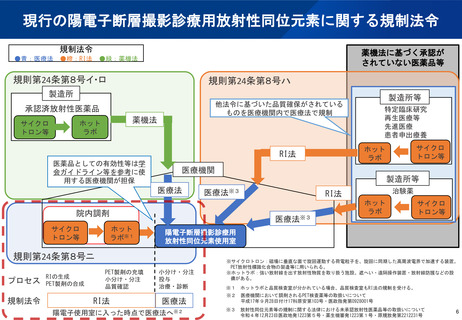
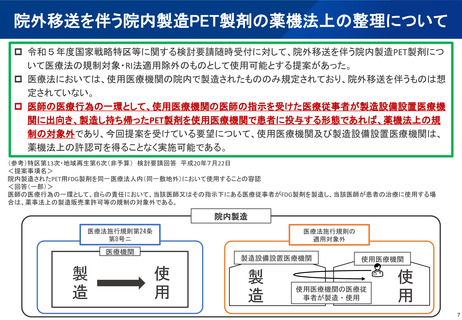
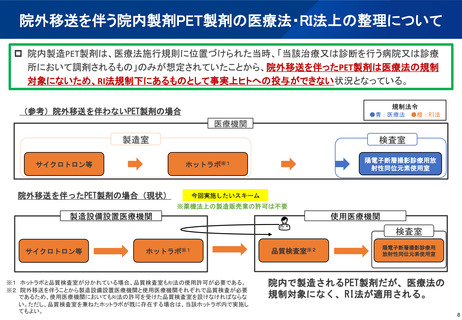
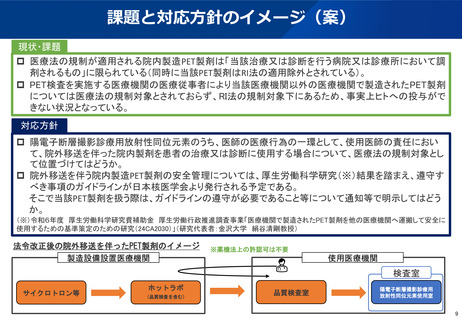
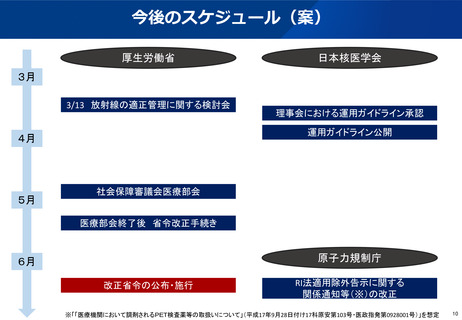
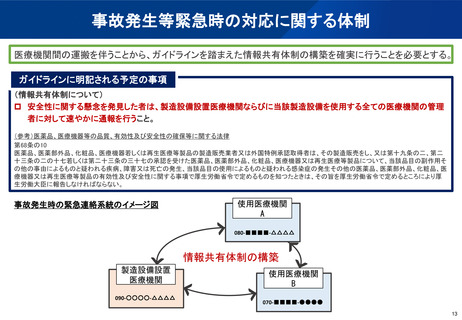
(参考)陽電子断層撮影診療用放射性同位元素の現在の取扱い
医療法
第十五条
一~二 (略)
三 病院又は診療所の管理者は、病院又は診療所に診療の用に供するエックス線装置を備えたときその他厚生労働省令で定める場
合においては、厚生労働省令の定めるところにより、病院又は診療所所在地の都道府県知事に届け出なければならない。
医療法施行規則
第二十四条 法第十五条第三項の厚生労働省令で定める場合は、次に掲げる場合とする。
一~七 (略)
八 病院又は診療所に、密封されていない放射性同位元素であつて陽電子放射断層撮影装置による画像診断に用いるもののうち、
次に掲げるもの(以下「陽電子断層撮影診療用放射性同位元素」という。)を備えようとする場合
イ 第一条の十一第二項第二号ハ(2)に規定する医薬品
ロ 医薬品医療機器等法第二十三条の二の五第一項若しくは第二十三条の二の十七第一項の承認(医薬品医療機器等法第二十三
条の二の五第十五項(医薬品医療機器等法第二十三条の二の十七第五項において準用する場合を含む。)の変更の承認を含
む。)若しくは医薬品医療機器等法第二十三条の二の二十三第一項の認証(同条第七項の変更の認証を含む。)を受けている
体外診断用医薬品又は医薬品医療機器等法第二十三条の二の十二第一項の規定による届出(同条第二項の規定による変更の届
出を含む。)が行われている体外診断用医薬品
ハ 第一条の十一第二項第二号ハ(1)に規定するもの又は薬物のうち、次に掲げるもの
(1) 治験(医薬品医療機器等法第二条第十七項に規定する治験をいう。第三十条の三十二の二第一項第十三号及び別表第
一において同じ。)に用いるもの
(2) 臨床研究法第二条第二項に規定する特定臨床研究に用いるもの
(3) 再生医療等の安全性の確保等に関する法律(平成二十五年法律第八十五号)第二条第一項に規定する再生医療等に用
いるもの
(4) 厚生労働大臣の定める先進医療及び患者申出療養並びに施設基準(平成二十年厚生労働省告示第百二十九号)第二各
号若しくは第三各号に掲げる先進医療又は第四に掲げる患者申出療養に用いるもの
ニ 治療又は診断のために医療を受ける者に対し投与される医薬品であつて、当該治療又は診断を行う病院又は診療所において
調剤されるもの(イからハまでに該当するものを除く。)
八の二 病院又は診療所に、密封されていない放射性同位元素であつて陽電子放射断層撮影装置による画像診断に用いないものの
うち、前号イからハまでに掲げるもの(以下「診療用放射性同位元素」という。)を備えようとする場合
九 病院又は診療所に、診療用放射性同位元素又は陽電子断層撮影診療用放射性同位元素を備えている場合
十~十三 (略)
16
医療法
第十五条
一~二 (略)
三 病院又は診療所の管理者は、病院又は診療所に診療の用に供するエックス線装置を備えたときその他厚生労働省令で定める場
合においては、厚生労働省令の定めるところにより、病院又は診療所所在地の都道府県知事に届け出なければならない。
医療法施行規則
第二十四条 法第十五条第三項の厚生労働省令で定める場合は、次に掲げる場合とする。
一~七 (略)
八 病院又は診療所に、密封されていない放射性同位元素であつて陽電子放射断層撮影装置による画像診断に用いるもののうち、
次に掲げるもの(以下「陽電子断層撮影診療用放射性同位元素」という。)を備えようとする場合
イ 第一条の十一第二項第二号ハ(2)に規定する医薬品
ロ 医薬品医療機器等法第二十三条の二の五第一項若しくは第二十三条の二の十七第一項の承認(医薬品医療機器等法第二十三
条の二の五第十五項(医薬品医療機器等法第二十三条の二の十七第五項において準用する場合を含む。)の変更の承認を含
む。)若しくは医薬品医療機器等法第二十三条の二の二十三第一項の認証(同条第七項の変更の認証を含む。)を受けている
体外診断用医薬品又は医薬品医療機器等法第二十三条の二の十二第一項の規定による届出(同条第二項の規定による変更の届
出を含む。)が行われている体外診断用医薬品
ハ 第一条の十一第二項第二号ハ(1)に規定するもの又は薬物のうち、次に掲げるもの
(1) 治験(医薬品医療機器等法第二条第十七項に規定する治験をいう。第三十条の三十二の二第一項第十三号及び別表第
一において同じ。)に用いるもの
(2) 臨床研究法第二条第二項に規定する特定臨床研究に用いるもの
(3) 再生医療等の安全性の確保等に関する法律(平成二十五年法律第八十五号)第二条第一項に規定する再生医療等に用
いるもの
(4) 厚生労働大臣の定める先進医療及び患者申出療養並びに施設基準(平成二十年厚生労働省告示第百二十九号)第二各
号若しくは第三各号に掲げる先進医療又は第四に掲げる患者申出療養に用いるもの
ニ 治療又は診断のために医療を受ける者に対し投与される医薬品であつて、当該治療又は診断を行う病院又は診療所において
調剤されるもの(イからハまでに該当するものを除く。)
八の二 病院又は診療所に、密封されていない放射性同位元素であつて陽電子放射断層撮影装置による画像診断に用いないものの
うち、前号イからハまでに掲げるもの(以下「診療用放射性同位元素」という。)を備えようとする場合
九 病院又は診療所に、診療用放射性同位元素又は陽電子断層撮影診療用放射性同位元素を備えている場合
十~十三 (略)
16