よむ、つかう、まなぶ。
資料4-2 レベチラセタム (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00023.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第51回 6/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
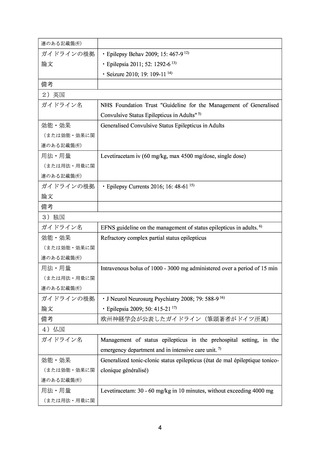
いる。
効能・効果:Status epilepticus
用法・用量:Levetiractam iv 20mg/kg over 15 mins
<日本におけるガイドライン等>
7) 日本神経学会. てんかん診療ガイドライン 2018. 3)
けいれん性てんかん重積状態の治療フローチャートにおいて、本薬がホスフェニトイン
と同等の第二選択薬として推奨されている。また、非けいれん性てんかん重積状態の治療
もけいれん性てんかん重積状態に準じる旨が記載されている。
効能・効果:てんかん重積状態
用法・用量:成人の場合 1 回 1000~3000 mg を静脈内投与(投与速度は 2~5 mg/kg/分)
小児の場合 1 回 20~60 mg/kg を静脈内投与、最大 3000 mg
6.本邦での開発状況(経緯)及び使用実態について
(1)要望内容に係る本邦での開発状況(経緯)等について
国内開発なし
(2)要望内容に係る本邦での臨床試験成績及び臨床使用実態について
「5. 要望内容に係る国内外の公表文献・成書等について」に記載したとおり、本邦での臨
床試験成績は報告がないが、レトロスペクティブな検討による本薬の使用実態が 6 報
29-34)
あ
り、うち 2 報では、てんかん重積状態に対して、要望された用法・用量で本薬が投与された。
また、既承認の効能効果を対象とした本薬の製造販売後調査における本要望内容の使用経験
は、以下のとおりであった。
2020 年 10 月の再審査申請時点での調査票実収集症例数 2515 例のうち、本剤の使用理由に
「重積」又は「NCSE(non-convulsive status epilepticus)
」の文字を含む調査票の例数は 129 例
(部分発作 122 例及び強直間代発作 10 例、3 例重複)であった。副作用が 10 例で報告され、
重篤な副作用は 5 例(肝機能異常 2 例、播種性血管内凝固・ショック、貧血及び心房細動各 1
例)であった。また、非けいれん性てんかん重積に本剤が投与された症例は 4 例であり、う
ち 1 例で有害事象(白血球数増加)が認められた。
7.公知申請の妥当性について
(1)要望内容に係る外国人におけるエビデンス及び日本人における有効性の総合評価につ
いて
海外で実施された無作為化比較試験において、本薬は他の第二選択薬(ホスフェニトイ
ン、バルプロ酸)と同程度の有効性が示されており、欧米等では、てんかん重積状態にあ
12
効能・効果:Status epilepticus
用法・用量:Levetiractam iv 20mg/kg over 15 mins
<日本におけるガイドライン等>
7) 日本神経学会. てんかん診療ガイドライン 2018. 3)
けいれん性てんかん重積状態の治療フローチャートにおいて、本薬がホスフェニトイン
と同等の第二選択薬として推奨されている。また、非けいれん性てんかん重積状態の治療
もけいれん性てんかん重積状態に準じる旨が記載されている。
効能・効果:てんかん重積状態
用法・用量:成人の場合 1 回 1000~3000 mg を静脈内投与(投与速度は 2~5 mg/kg/分)
小児の場合 1 回 20~60 mg/kg を静脈内投与、最大 3000 mg
6.本邦での開発状況(経緯)及び使用実態について
(1)要望内容に係る本邦での開発状況(経緯)等について
国内開発なし
(2)要望内容に係る本邦での臨床試験成績及び臨床使用実態について
「5. 要望内容に係る国内外の公表文献・成書等について」に記載したとおり、本邦での臨
床試験成績は報告がないが、レトロスペクティブな検討による本薬の使用実態が 6 報
29-34)
あ
り、うち 2 報では、てんかん重積状態に対して、要望された用法・用量で本薬が投与された。
また、既承認の効能効果を対象とした本薬の製造販売後調査における本要望内容の使用経験
は、以下のとおりであった。
2020 年 10 月の再審査申請時点での調査票実収集症例数 2515 例のうち、本剤の使用理由に
「重積」又は「NCSE(non-convulsive status epilepticus)
」の文字を含む調査票の例数は 129 例
(部分発作 122 例及び強直間代発作 10 例、3 例重複)であった。副作用が 10 例で報告され、
重篤な副作用は 5 例(肝機能異常 2 例、播種性血管内凝固・ショック、貧血及び心房細動各 1
例)であった。また、非けいれん性てんかん重積に本剤が投与された症例は 4 例であり、う
ち 1 例で有害事象(白血球数増加)が認められた。
7.公知申請の妥当性について
(1)要望内容に係る外国人におけるエビデンス及び日本人における有効性の総合評価につ
いて
海外で実施された無作為化比較試験において、本薬は他の第二選択薬(ホスフェニトイ
ン、バルプロ酸)と同程度の有効性が示されており、欧米等では、てんかん重積状態にあ
12