よむ、つかう、まなぶ。
資料4-2 レベチラセタム (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00023.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第51回 6/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
効能・効果
用法・用量
承認年月(または仏
国における開発の有
無)
備考
要望内容に関する承認はない(2022 年 3 月 28 日現在)。
ただし、仏国の公的医療保険では保険償還の対象とされている(2022
年 3 月 28 日現在)。
5)加国
効能・効果
用法・用量
承認年月(または加
国における開発の有
無)
備考
要望内容に関する承認はない(2022 年 3 月 28 日現在)。
ただし、加国の公的医療保険では保険償還の対象とされている(2022
年 3 月 28 日現在)。
6)豪州
効能・効果
用法・用量
承認年月(または豪
州における開発の有
無)
備考
要望内容に関する承認はない(2022 年 3 月 28 日現在)。
ただし、豪州の公的医療保険では保険償還の対象とされている(2022
年 3 月 28 日現在)。
(2) 欧米等6カ国での標準的使用状況について
1)米国
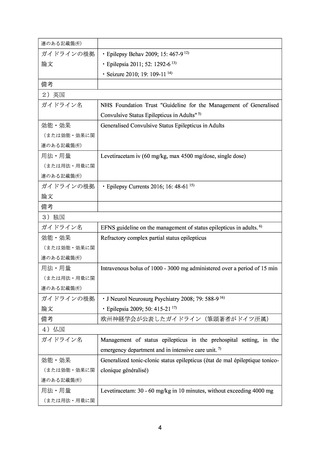
ガイドライン名
Neurocritical Care Society Guidelines for the Evaluation and Management
of Status Epilepticus. 4)
効能・効果
Status epilepticus
(または効能・効果に関
連のある記載箇所)
用法・用量
Levetiractam 1,000 - 3,000 mg IV、Peds: 20–60 mg/kg IV
(または用法・用量に関
3
用法・用量
承認年月(または仏
国における開発の有
無)
備考
要望内容に関する承認はない(2022 年 3 月 28 日現在)。
ただし、仏国の公的医療保険では保険償還の対象とされている(2022
年 3 月 28 日現在)。
5)加国
効能・効果
用法・用量
承認年月(または加
国における開発の有
無)
備考
要望内容に関する承認はない(2022 年 3 月 28 日現在)。
ただし、加国の公的医療保険では保険償還の対象とされている(2022
年 3 月 28 日現在)。
6)豪州
効能・効果
用法・用量
承認年月(または豪
州における開発の有
無)
備考
要望内容に関する承認はない(2022 年 3 月 28 日現在)。
ただし、豪州の公的医療保険では保険償還の対象とされている(2022
年 3 月 28 日現在)。
(2) 欧米等6カ国での標準的使用状況について
1)米国
ガイドライン名
Neurocritical Care Society Guidelines for the Evaluation and Management
of Status Epilepticus. 4)
効能・効果
Status epilepticus
(または効能・効果に関
連のある記載箇所)
用法・用量
Levetiractam 1,000 - 3,000 mg IV、Peds: 20–60 mg/kg IV
(または用法・用量に関
3