よむ、つかう、まなぶ。
資料4-2 レベチラセタム (15 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00023.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第51回 6/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
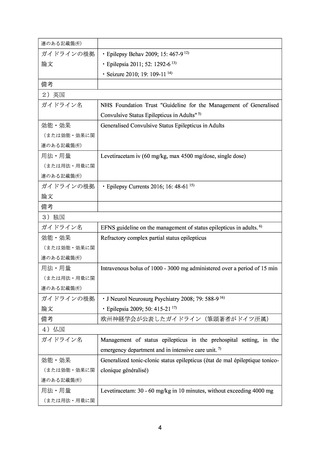
いずれの場合においても、症状により適宜増減できるが、1 日最高投与量及び増量方法は
以下のとおりとすること。
成人:成人では 1 日最高投与量は 3000 mg を超えないこととし、増量は 2 週間以上の
間隔をあけて 1 日用量として 1000 mg 以下ずつ行う。
小児:4 歳以上の小児では 1 日最高投与量は 60 mg/kg を超えないこととし、増量は 2
週間以上の間隔をあけて 1 日用量として 20 mg/kg 以下ずつ行う。ただし、体重 50 kg
以上の小児では、成人と同じ投与量を用いること。
〈てんかん重積状態〉
成人の場合 1 回 1000~3000 mg を静脈内投与(投与速度は 2~5 mg/kg/分で静脈内投与す
る)するが、1 日最大投与量は 3000 mg とする。
【設定の妥当性について】
本薬の1000~3000 mg投与は国内で使用されている用量であり、国内外の診療ガイドライ
ンの記載内容を踏まえ、当該用法・用量は医学薬学上公知であると考えることから(「7.(3)
要望内容に係る公知申請の妥当性について」の項参照)、当該用法・用量を設定とするこ
とが妥当と判断した。
9.要望内容に係る更なる使用実態調査等の必要性について
(1)要望内容について現時点で国内外のエビデンスまたは臨床使用実態が不足している点
の有無について
国内外の臨床試験成績、国際的な教科書及び国内外の診療ガイドラインの記載内容等を
踏まえて、本薬のてんかん重積状態に対する有用性は医学薬学上公知であると考える。安
全性について、国内外の公表文献等で認められたてんかん重積状態に対する本薬投与時の
有害事象は、本薬の既承認の効能・効果において既知の事象であり、本薬の現行の添付文
書に準じて使用される限り、安全性は許容可能と考える。したがって、現時点で追加すべ
き試験又は調査はないと考える。
(2)上記(1)で臨床使用実態が不足している場合は、必要とされる使用実態調査等の内
容について
なし。
(3)その他、製造販売後における留意点について
なし。
15
以下のとおりとすること。
成人:成人では 1 日最高投与量は 3000 mg を超えないこととし、増量は 2 週間以上の
間隔をあけて 1 日用量として 1000 mg 以下ずつ行う。
小児:4 歳以上の小児では 1 日最高投与量は 60 mg/kg を超えないこととし、増量は 2
週間以上の間隔をあけて 1 日用量として 20 mg/kg 以下ずつ行う。ただし、体重 50 kg
以上の小児では、成人と同じ投与量を用いること。
〈てんかん重積状態〉
成人の場合 1 回 1000~3000 mg を静脈内投与(投与速度は 2~5 mg/kg/分で静脈内投与す
る)するが、1 日最大投与量は 3000 mg とする。
【設定の妥当性について】
本薬の1000~3000 mg投与は国内で使用されている用量であり、国内外の診療ガイドライ
ンの記載内容を踏まえ、当該用法・用量は医学薬学上公知であると考えることから(「7.(3)
要望内容に係る公知申請の妥当性について」の項参照)、当該用法・用量を設定とするこ
とが妥当と判断した。
9.要望内容に係る更なる使用実態調査等の必要性について
(1)要望内容について現時点で国内外のエビデンスまたは臨床使用実態が不足している点
の有無について
国内外の臨床試験成績、国際的な教科書及び国内外の診療ガイドラインの記載内容等を
踏まえて、本薬のてんかん重積状態に対する有用性は医学薬学上公知であると考える。安
全性について、国内外の公表文献等で認められたてんかん重積状態に対する本薬投与時の
有害事象は、本薬の既承認の効能・効果において既知の事象であり、本薬の現行の添付文
書に準じて使用される限り、安全性は許容可能と考える。したがって、現時点で追加すべ
き試験又は調査はないと考える。
(2)上記(1)で臨床使用実態が不足している場合は、必要とされる使用実態調査等の内
容について
なし。
(3)その他、製造販売後における留意点について
なし。
15