よむ、つかう、まなぶ。
【資料5】医薬品等行政評価・監視委員会における海外調査の状況 (14 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27999.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第9回 9/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
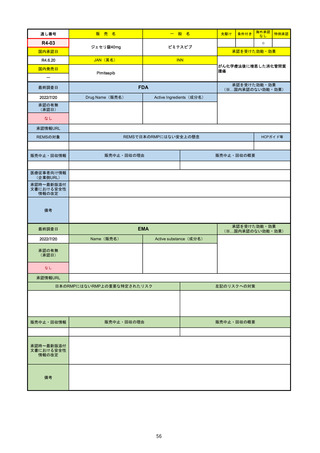
販
通し番号
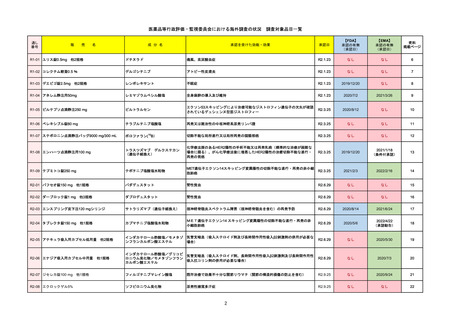
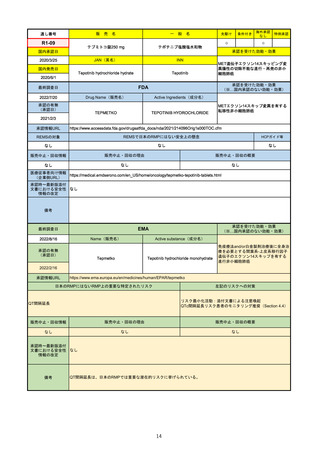
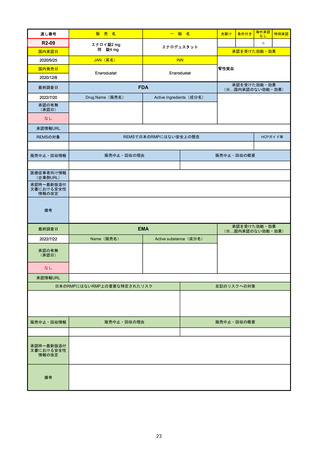
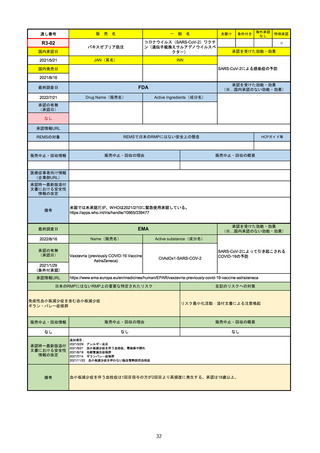
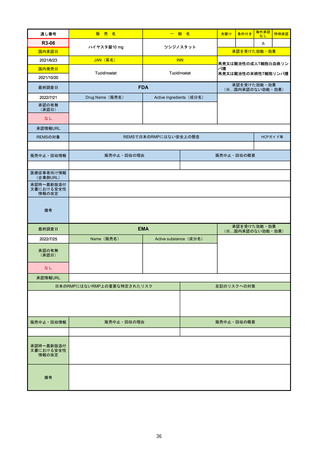
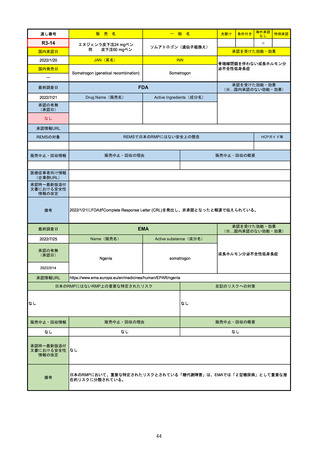
R1-09
売
名
一
テプミトコ錠250 mg
般
名
先駆け
条件付き
海外承認
なし
特例承認
○
0
○
0
テポチニブ塩酸塩水和物
承認を受けた効能・効果
国内承認日
2020/3/25
国内発売日
JAN(英名)
INN
Tepotinib hydrochloride hydrate
Tepotinib
2020/6/1
MET遺伝子エクソン14スキッピング変
異陽性の切除不能な進行・再発の非小
細胞肺癌
承認を受けた効能・効果
(※…国内承認のない効能・効果)
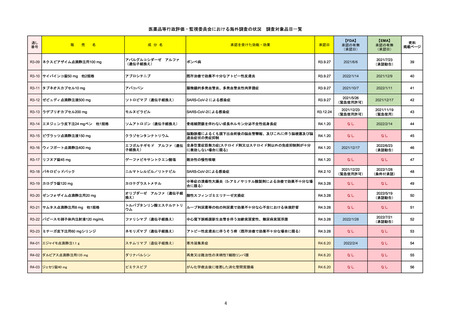
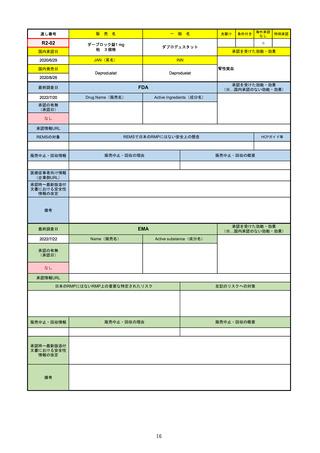
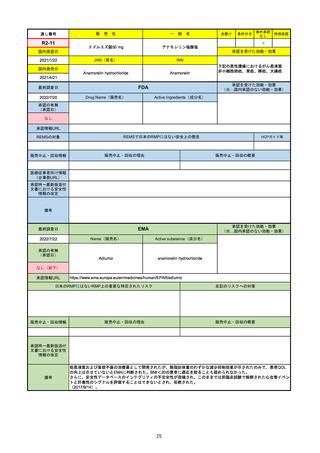
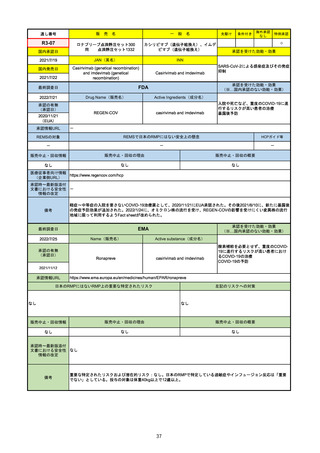
FDA
最終調査日
Drug Name(販売名)
2022/7/20
承認の有無
(承認日)
Active Ingredients(成分名)
TEPMETKO
TEPOTINIB HYDROCHLORIDE
METエクソン14スキップ変異を有する
転移性非小細胞肺癌
2021/2/3
承認情報URL
https://www.accessdata.fda.gov/drugsatfda_docs/nda/2021/214096Orig1s000TOC.cfm
REMSの対象
REMSで日本のRMPにはない安全上の懸念
HCPガイド等
なし
なし
なし
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
医療従事者向け情報
https://medical.emdserono.com/en_US/home/oncology/tepmetko-tepotinib-tablets.html
(企業側URL)
承認時~最新版添付
文書における安全性 なし
情報の改定
0
備考
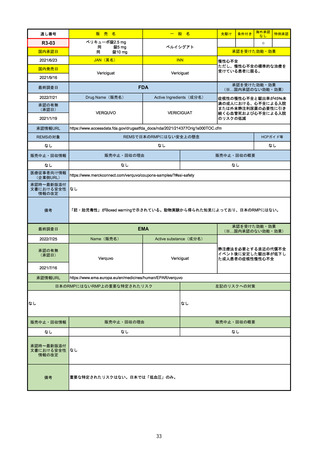
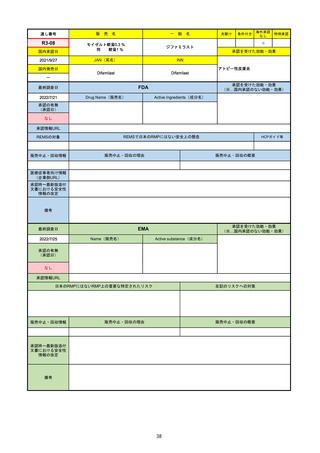
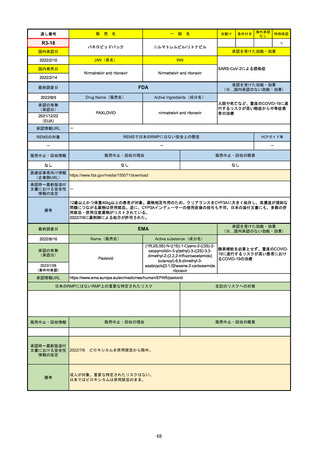
承認を受けた効能・効果
(※…国内承認のない効能・効果)
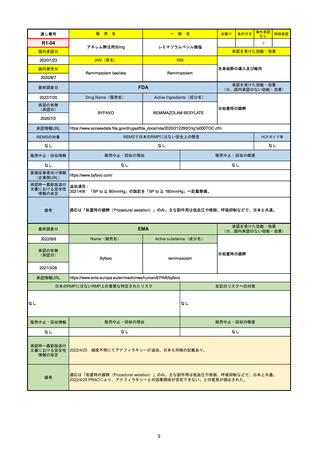
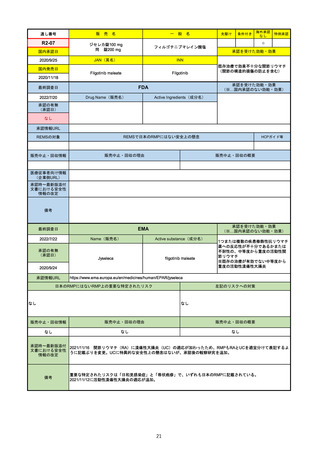
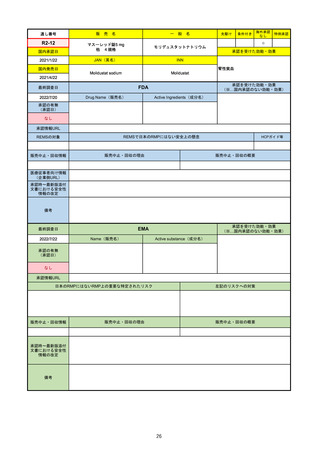
EMA
最終調査日
Name(販売名)
2022/8/16
承認の有無
(承認日)
Tepmetko
Active substance(成分名)
Tepotinib hydrochloride monohydrate
免疫療法and/or白金製剤治療後に全身治
療を必要とする間葉系-上皮系移行因子
遺伝子のエクソン14スキップを有する
進行非小細胞肺癌
2022/2/16
承認情報URL
https://www.ema.europa.eu/en/medicines/human/EPAR/tepmetko
日本のRMPにはないRMP上の重要な特定されたリスク
左記のリスクへの対策
リスク最小化活動:添付文書による注意喚起
QTc間隔延長リスク患者のモニタリング推奨(Section 4.4)
QT間隔延長
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
承認時~最新版添付
文書における安全性 なし
情報の改定
備考
QT間隔延長は、日本のRMPでは重要な潜在的リスクに挙げられている。
14
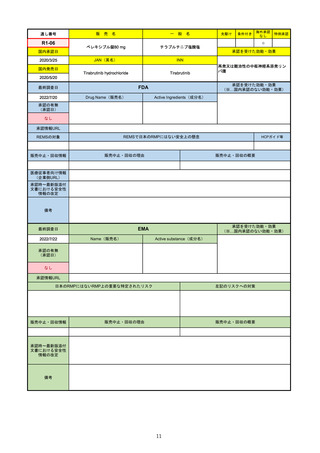
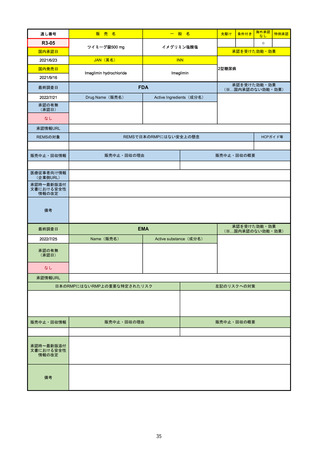
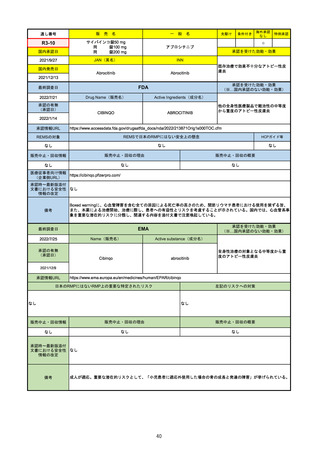
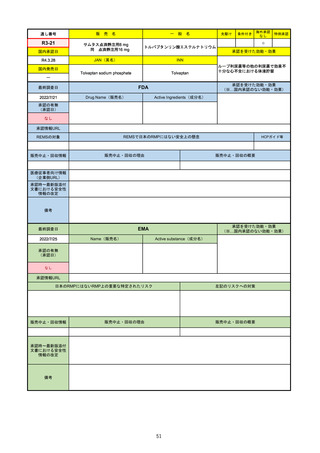
通し番号
R1-09
売
名
一
テプミトコ錠250 mg
般
名
先駆け
条件付き
海外承認
なし
特例承認
○
0
○
0
テポチニブ塩酸塩水和物
承認を受けた効能・効果
国内承認日
2020/3/25
国内発売日
JAN(英名)
INN
Tepotinib hydrochloride hydrate
Tepotinib
2020/6/1
MET遺伝子エクソン14スキッピング変
異陽性の切除不能な進行・再発の非小
細胞肺癌
承認を受けた効能・効果
(※…国内承認のない効能・効果)
FDA
最終調査日
Drug Name(販売名)
2022/7/20
承認の有無
(承認日)
Active Ingredients(成分名)
TEPMETKO
TEPOTINIB HYDROCHLORIDE
METエクソン14スキップ変異を有する
転移性非小細胞肺癌
2021/2/3
承認情報URL
https://www.accessdata.fda.gov/drugsatfda_docs/nda/2021/214096Orig1s000TOC.cfm
REMSの対象
REMSで日本のRMPにはない安全上の懸念
HCPガイド等
なし
なし
なし
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
医療従事者向け情報
https://medical.emdserono.com/en_US/home/oncology/tepmetko-tepotinib-tablets.html
(企業側URL)
承認時~最新版添付
文書における安全性 なし
情報の改定
0
備考
承認を受けた効能・効果
(※…国内承認のない効能・効果)
EMA
最終調査日
Name(販売名)
2022/8/16
承認の有無
(承認日)
Tepmetko
Active substance(成分名)
Tepotinib hydrochloride monohydrate
免疫療法and/or白金製剤治療後に全身治
療を必要とする間葉系-上皮系移行因子
遺伝子のエクソン14スキップを有する
進行非小細胞肺癌
2022/2/16
承認情報URL
https://www.ema.europa.eu/en/medicines/human/EPAR/tepmetko
日本のRMPにはないRMP上の重要な特定されたリスク
左記のリスクへの対策
リスク最小化活動:添付文書による注意喚起
QTc間隔延長リスク患者のモニタリング推奨(Section 4.4)
QT間隔延長
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
承認時~最新版添付
文書における安全性 なし
情報の改定
備考
QT間隔延長は、日本のRMPでは重要な潜在的リスクに挙げられている。
14