よむ、つかう、まなぶ。
別紙6○先進医療Aに係る新規技術の科学的評価等について (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00052.html |
| 出典情報 | 先進医療会議(第116回 11/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2.モニタリングについて
「届出書」の 14 ページにはモニタリングの方法について詳しい記載がありますが、
「研究実施計画書」の 12 ページには、モニタリングは「該当しないため記載省略」とあり
ます。
モニタリング実施の有無や方法につき、統一した記載としてください。
【回答】
ご指摘のように、記載が一致しておらず申し訳ございません。研究実施計画書に記載
されておりますように、本研究は患者に対して通常医療を超える侵襲はなく、モニタリ
ングは不要として倫理審査委員会で承認を得ておりますので、実施届出書を修正させ
ていただきました。
3.データセンターについて
「届出書」の 15~16 ページには「データセンター」の記載があり、データの保管も行い
ます。一方で「届出書」「研究実施計画書」には、どこがデータセンター機能を持つのか記
載がありません。データセンター機能を含め、データ管理の責任機関につきご提示くださ
い。また、必要に応じて、「届出書」「研究実施計画書」への記載をお願いいたします。
【回答】
データセンター機能は当院(大阪大学医学部附属病院)が担い、協力医療機関の症例
も含めて、データ管理の責任機関も当院となります。実施届出書及び研究実施計画書に
追記を行いました。
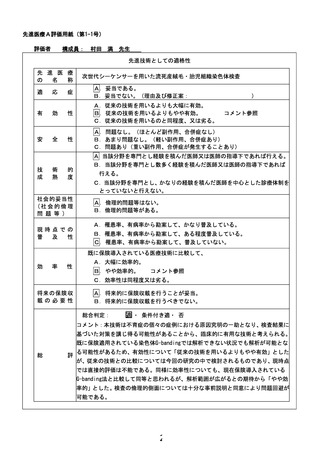
4.薬事承認申請における本先進医療の位置づけ
提示されたロードマップには薬事承認申請が最終ゴールとして記載されています。タカ
ラバイオ社がソフトウェアをプログラム医療機器として申請するものと理解しますが、本先
進医療の結果を臨床性能試験として、申請時に使用するのでしょうか。ロードマップには
本先進医療の下に別に「臨床性能試験、分析性能試験」の記載があり、「試験計画を
PMDA と相談予定」との記載もあります。本先進医療の成果は薬事承認申請にどのよう
に活用されるか、ご説明ください。また、活用される場合は、本先進医療の評価項目や症
例数が PMDA の合意を得られる見込みがあるか否かもご教示ください。
【回答】
タカラバイオ社が流死産物の塩基配列より染色体の異数性を検出するプログラム医
療機器として申請予定です。申請にあたっては、臨床性能試験、分析性能試験の一部と
して当該先進医療で得るデータを使用予定です。
現時点の進捗を反映し、ロードマップを修正させていただきました。具体的には既存
の検査方法である G-Banding 法との比較試験を行い、解析実施可能症例数(ロードマ
ップの臨床性能:主要項目及び副次項目②)、既知流死産原因の推定結果の一致率(ロ
8
「届出書」の 14 ページにはモニタリングの方法について詳しい記載がありますが、
「研究実施計画書」の 12 ページには、モニタリングは「該当しないため記載省略」とあり
ます。
モニタリング実施の有無や方法につき、統一した記載としてください。
【回答】
ご指摘のように、記載が一致しておらず申し訳ございません。研究実施計画書に記載
されておりますように、本研究は患者に対して通常医療を超える侵襲はなく、モニタリ
ングは不要として倫理審査委員会で承認を得ておりますので、実施届出書を修正させ
ていただきました。
3.データセンターについて
「届出書」の 15~16 ページには「データセンター」の記載があり、データの保管も行い
ます。一方で「届出書」「研究実施計画書」には、どこがデータセンター機能を持つのか記
載がありません。データセンター機能を含め、データ管理の責任機関につきご提示くださ
い。また、必要に応じて、「届出書」「研究実施計画書」への記載をお願いいたします。
【回答】
データセンター機能は当院(大阪大学医学部附属病院)が担い、協力医療機関の症例
も含めて、データ管理の責任機関も当院となります。実施届出書及び研究実施計画書に
追記を行いました。
4.薬事承認申請における本先進医療の位置づけ
提示されたロードマップには薬事承認申請が最終ゴールとして記載されています。タカ
ラバイオ社がソフトウェアをプログラム医療機器として申請するものと理解しますが、本先
進医療の結果を臨床性能試験として、申請時に使用するのでしょうか。ロードマップには
本先進医療の下に別に「臨床性能試験、分析性能試験」の記載があり、「試験計画を
PMDA と相談予定」との記載もあります。本先進医療の成果は薬事承認申請にどのよう
に活用されるか、ご説明ください。また、活用される場合は、本先進医療の評価項目や症
例数が PMDA の合意を得られる見込みがあるか否かもご教示ください。
【回答】
タカラバイオ社が流死産物の塩基配列より染色体の異数性を検出するプログラム医
療機器として申請予定です。申請にあたっては、臨床性能試験、分析性能試験の一部と
して当該先進医療で得るデータを使用予定です。
現時点の進捗を反映し、ロードマップを修正させていただきました。具体的には既存
の検査方法である G-Banding 法との比較試験を行い、解析実施可能症例数(ロードマ
ップの臨床性能:主要項目及び副次項目②)、既知流死産原因の推定結果の一致率(ロ
8