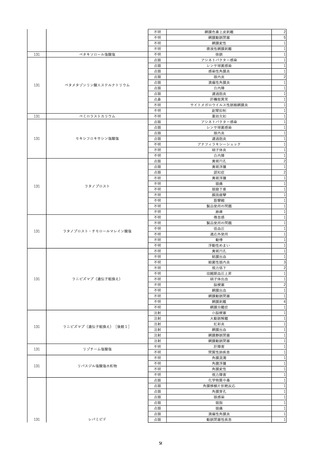
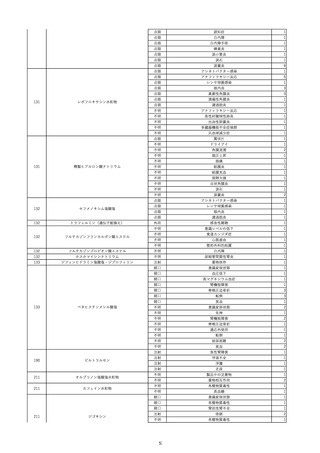
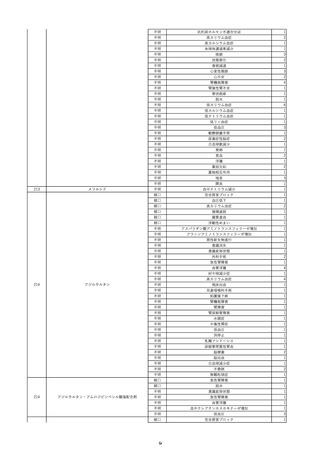
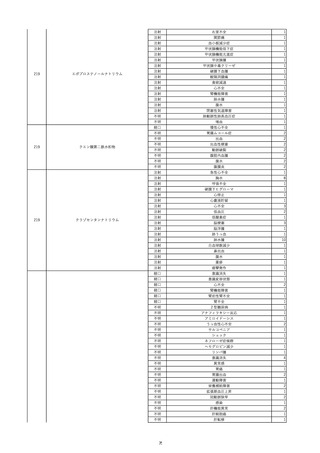
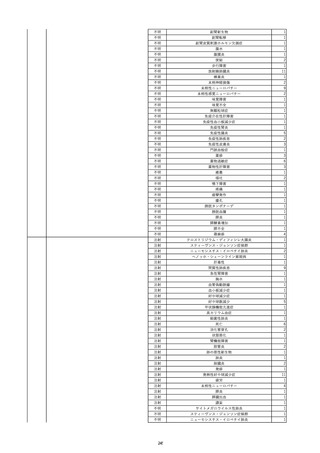
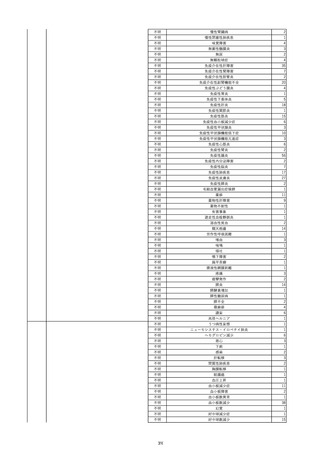
資料5-2 製造販売業者からの国内副作用等報告の状況 (469 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29460.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第3回 12/1)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
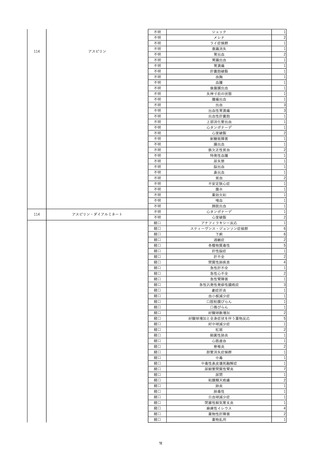
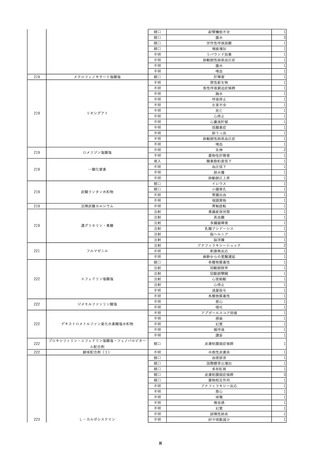
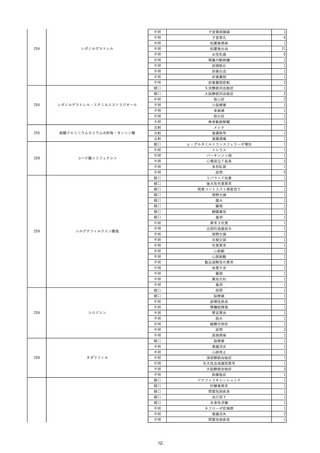
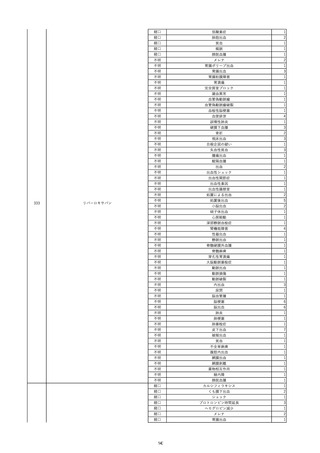
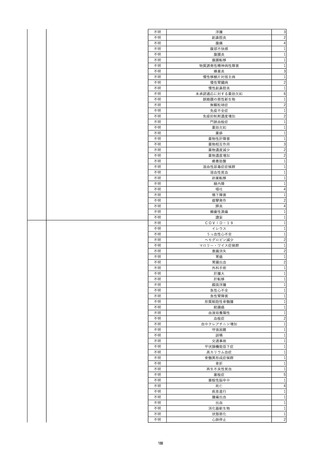
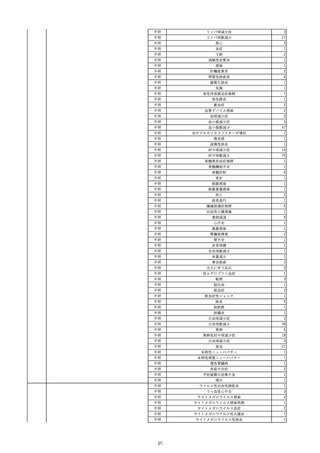
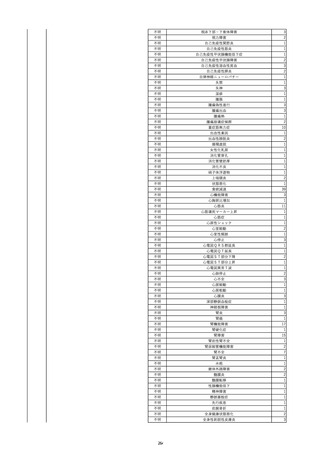
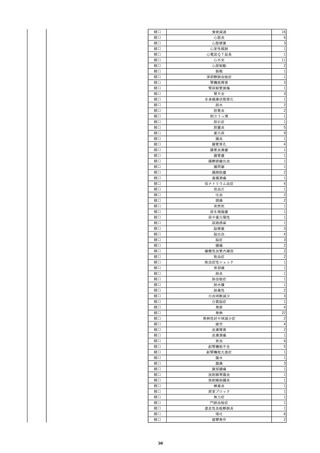
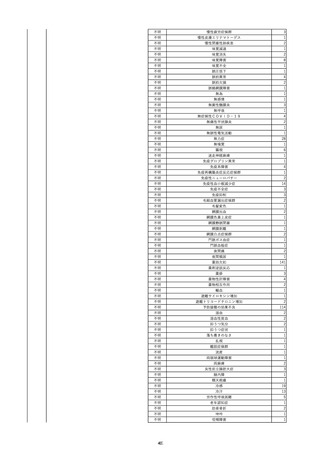
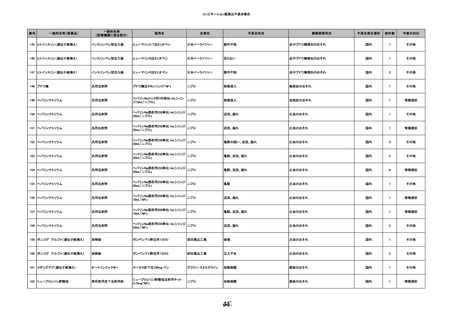
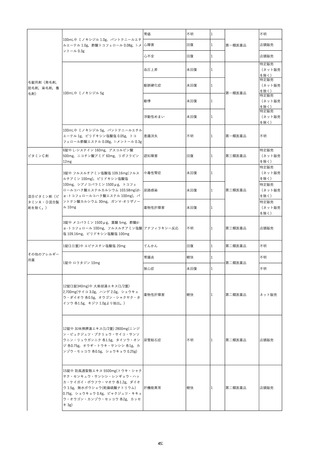
8
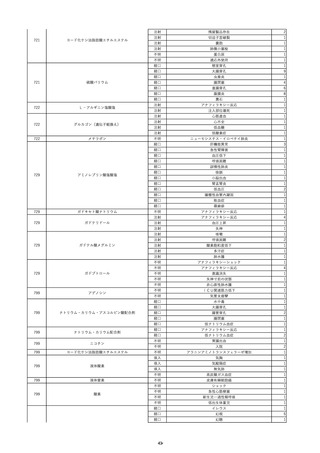
報告受領日
2022/6/7
販売名(一般名)
患者
性別
照射赤血球液-LR(人赤血球液(放
射線照射))
新鮮凍結血漿-LR(新鮮凍結人血
男
漿)
照射濃厚血小板-LR(人血小板濃厚
液(放射線照射))
年代
原疾患(簡略名)
60 血液腫瘍
感染症名
E型肝炎
投与年月
20/09
投与前検査(年月)
-
企業投与前
検査
投与後検査(年月)
HEV-IgA-Ab (+)
(22/05)
(検体なし)
企業投与後
検査
受血者個別NAT
HEV-RNA(-)、HEV-IgA-Ab(-)、
HEV-IgM-Ab(+)、HEV-IgG-Ab(+) 陰性(輸血後)
(22/05)
献血者個別NAT
備考
10名の保管検体の個別NAT
は全てHEV-RNA(-)、16名
の個別NATは全てHEV-RNA
(-)
HBsAg(+)
(22/04)
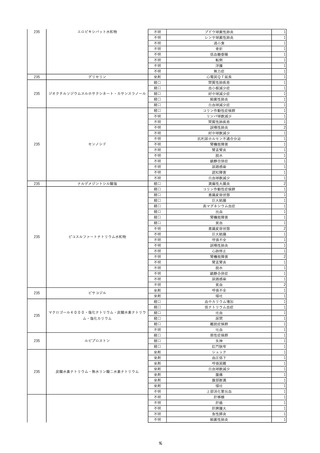
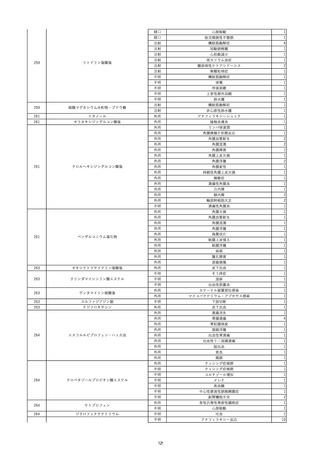
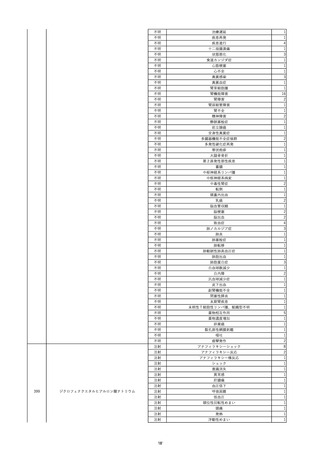
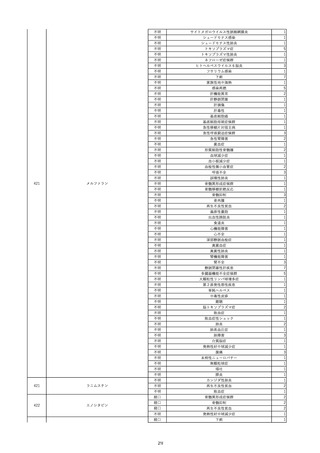
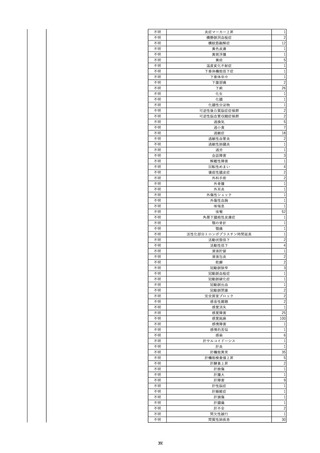
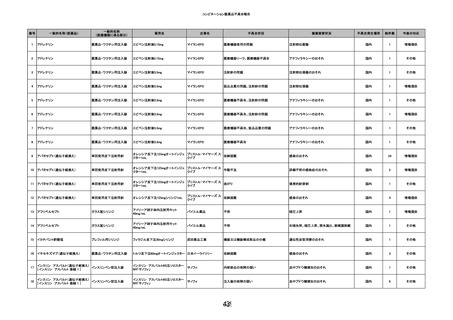
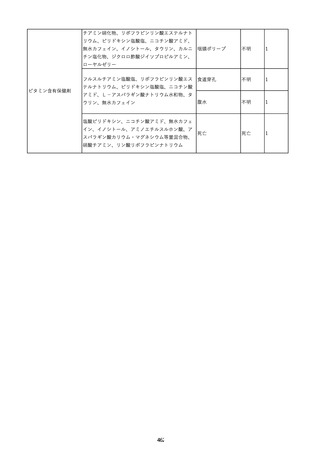
9
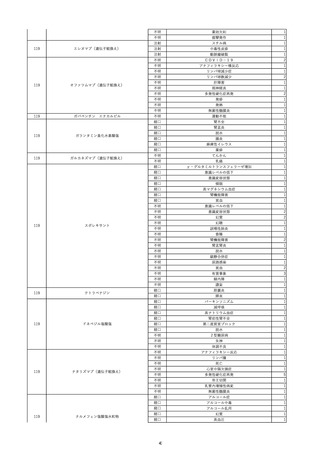
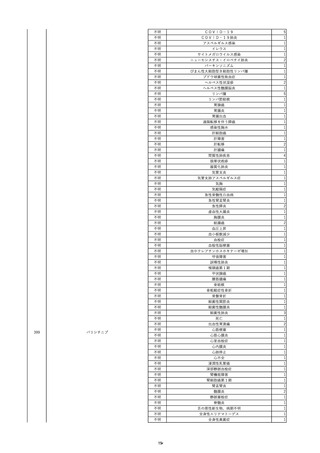
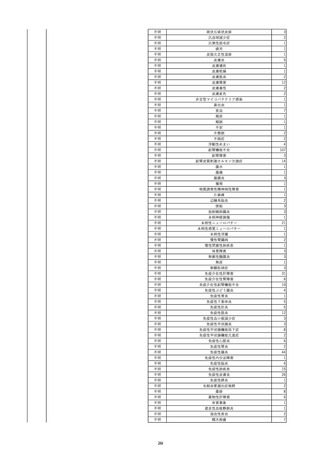
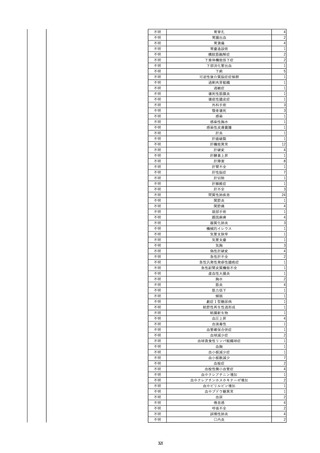
照射赤血球液-LR(人赤血球液(放
2022/6/7
射線照射))
男
70 外傷・整形外科的疾患
B型肝炎
HBsAg(-)
(19/01)
HBV-DNA(-)、HBsAg(-)、HBsAb(-)、HBcAb(+)、HBeAg(-)、HBeAb(-)
(22/05)
HBsAg(-)、HBsAb(-)、HBcAb(-)
(21/10)
HBV-DNA(-)、HBsAg(-)、HBsAb(-)、HBcAb(+)、HBeAg(-)、HBeAb(-)
(22/06)
21/10
HBV-DNA(-)、HBsAg(-)、HBsAb
(-)、HBcAb(+)
HBV-DNA(-)、HBsAg(-)、HBsAb (22/04)
陰性(輸血前)
(-)、HBcAb(-)
陰性(輸血後)
(21/10)
HBV-DNA(-)、HBsAg(-)、HBsAb
(-)、HBcAb(+)
(22/06)
2名の個別NATはHBV-DNA
(-)
同一採血番号の血漿にて無菌試験を実施し、適合。
-
HBsAg(-)(22/04採血検体再検査)
(22/06)
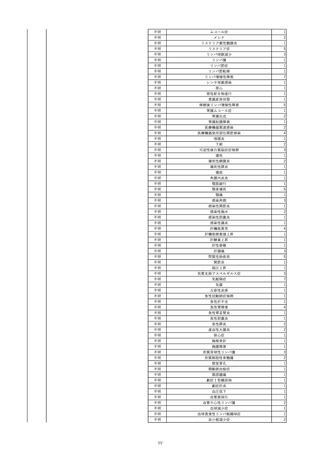
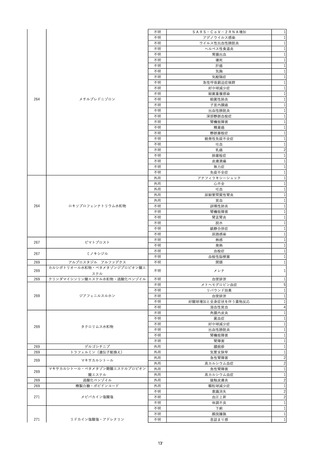
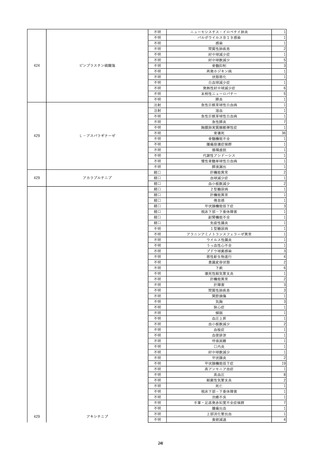
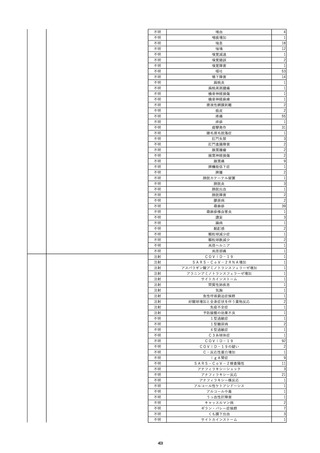
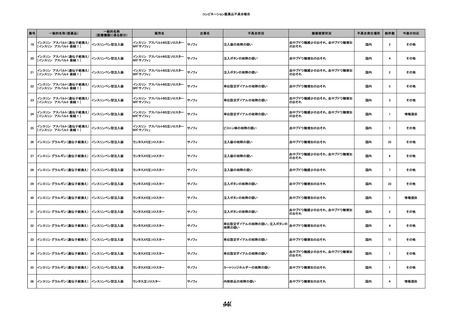
10
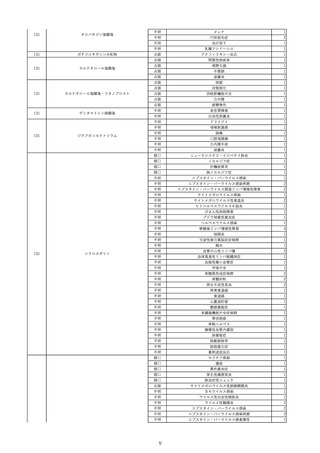
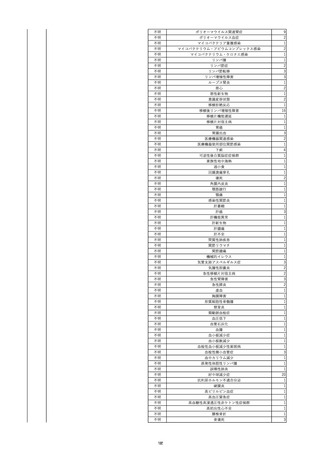
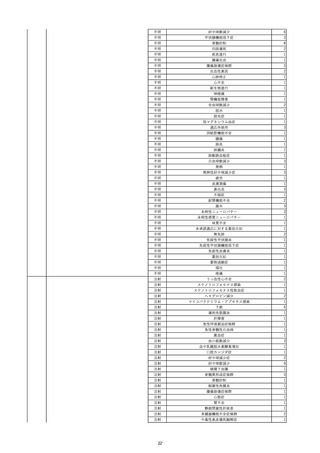
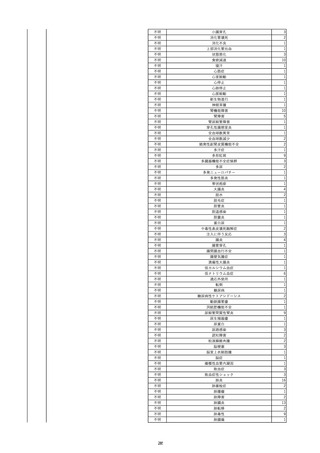
2022/6/15
照射濃厚血小板-LR(人血小板濃厚
男
液(放射線照射))
60
腎・泌尿器系疾患
その他の疾患
細菌感染
22/06
輸血開始3分前 BT 37.3℃、BP 155/95
mmHg、HR 80 /min、SpO2 95%。
輸血開始1時間7分後 輸血終了。
輸血終了30分後 悪寒、発熱あり。BT 39.0℃、BP 120/80 mmHg、HR 120 /min、SpO2 92%。
血液培養検査実施。
輸血終了1時間6分後 アセトアミノフェン投与。
輸血終了1時間59分後 BT 39.6℃、BP 120/78 mmHg、HR 120 /min、SpO2 95%。
輸血終了10時間35分後 BT 37.4℃、BP 142/83 mmHg、HR 70 /min、SpO2 96%。
-
輸血翌日 BT 36.6℃、BP 135/83 mmHg、HR 70 /min、SpO2 99%。
輸血日実施の患者血液培養検査よりメチシリン感受性黄色ブドウ球菌を検出。
HBsAg(-)
(06/04)
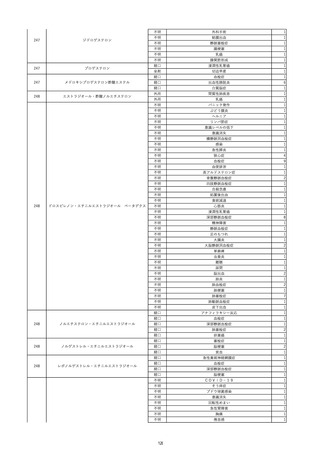
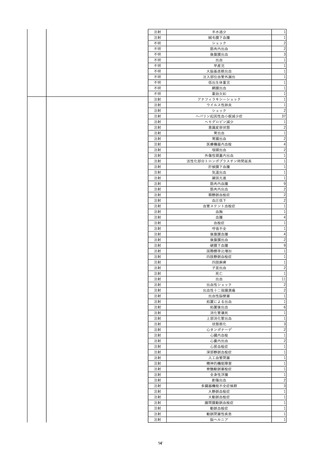
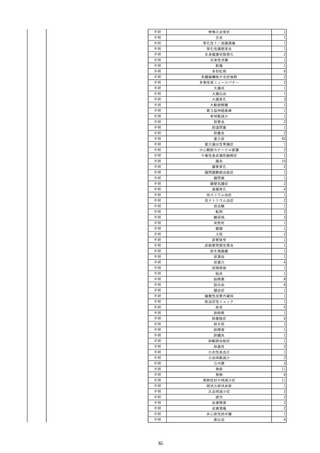
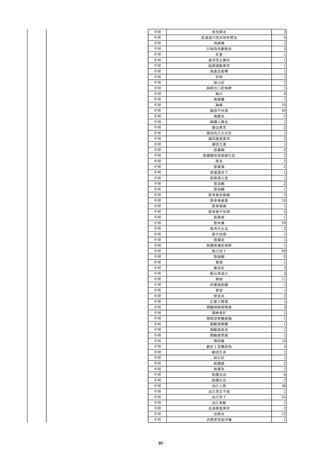
11
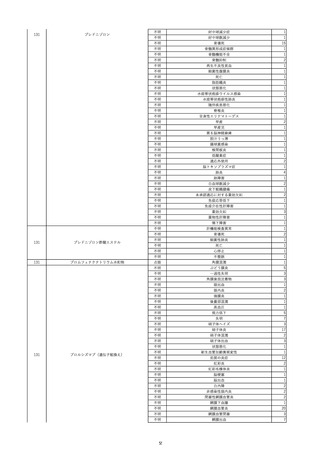
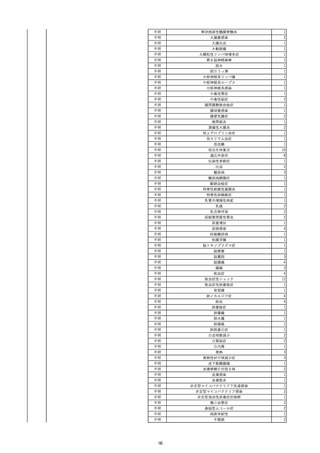
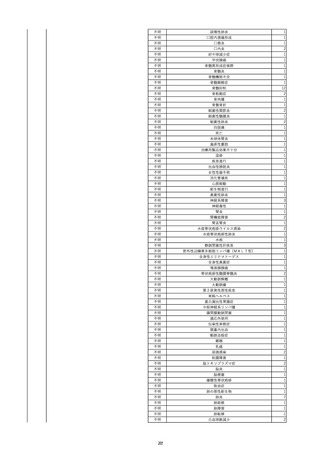
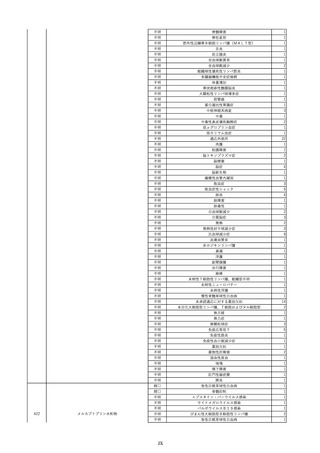
2022/6/16
照射赤血球液-LR(人赤血球液(放
射線照射))
女
肝・胆・膵疾患
循環器疾患
消化器腫瘍
90 腎・泌尿器系疾患
その他の疾患
肝・胆・膵腫瘍
消化器疾患
B型肝炎
HBsAg(-)
(19/08)
HBV-DNA(+)
(22/05)
HBsAg(-)
(21/05)
HBV-DNA(+)、HBsAg(-)、HBsAb(+)、HBcAb(+)、HBeAg(-)、HBeAb(+)
(22/06)
22/02
HBV-DNA(-)、HBsAg(-)、HBsAb HBV-DNA(-)、HBsAg(-)、HBsAb
陰性(輸血前)
(+)、HBcAb(+)
(+)、HBcAb(+)
陰性(輸血後)
(22/02)
(22/06)
2名の個別NATはHBV-DNA
(-)
当該輸血用血液の使用済みバッグ内残渣にて細菌培養試験及びエンドトキ
シン試験を実施。
細菌培養試験:陰性。
エンドトキシン試験:基準値以下。
-
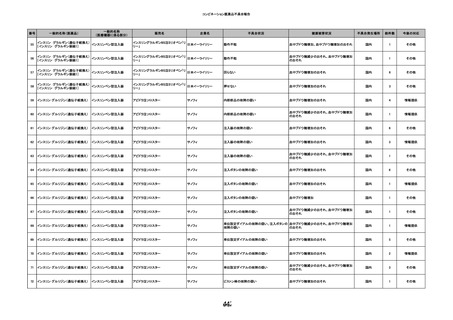
HBV-DNA(-)、HBsAg(-)、HBsAb HBV-DNA(+)、HBsAg(+)、HBsAb
陰性(輸血前)
(-)、HBcAb(-)
(-)、HBcAb(+)
陽性(輸血後)
(21/12)
(22/06)
9名の個別NATはHBV-DNA
(-)
調査中
調査中
HBsAg(-)
(22/02)
輸血2日後 BT 37.6℃、BP 135/82 mmHg、HR 72 /min、SpO2 88%。
バイタル測定2時間55分後 BT 40.7℃、BP 93/34 mmHg、HR 92 /min、SpO2 83%。
血液培養検査実施。
抗菌薬(セフェピム塩酸塩)投与開始。
バイタル測定5時間10分後 O2 2 L/min開始。BT 39.8℃、BP 104/64 mmHg、HR 90 /min、SpO2 95%(O2 2 L/min)。
バイタル測定6時間54分後 BT 38.5℃、BP 90/44 mmHg、HR 80 /min、SpO2 95%(O2 2 L/min)。
レノグラスチム(遺伝子組換え)投与。
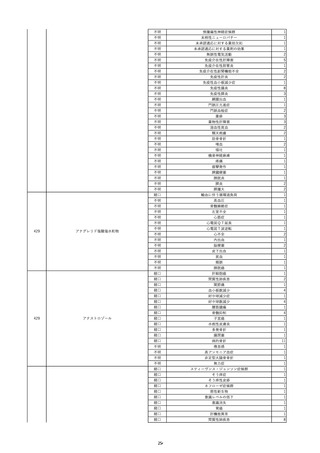
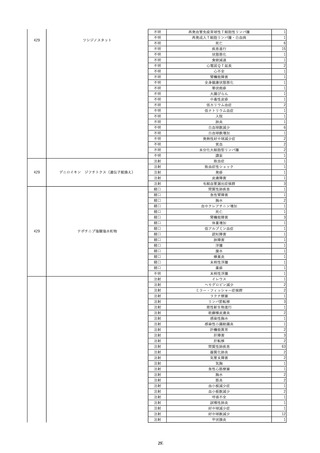
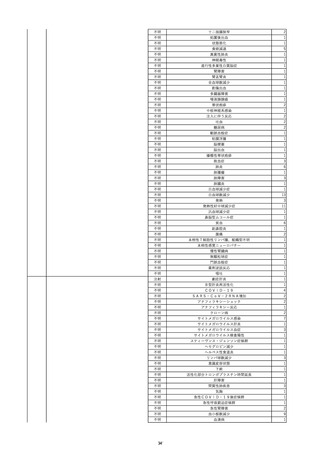
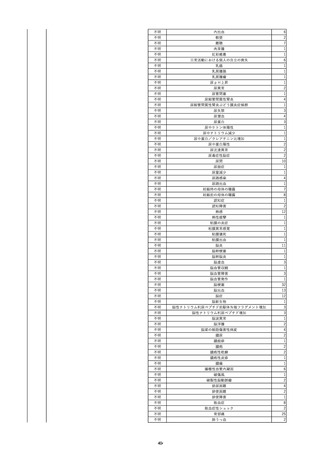
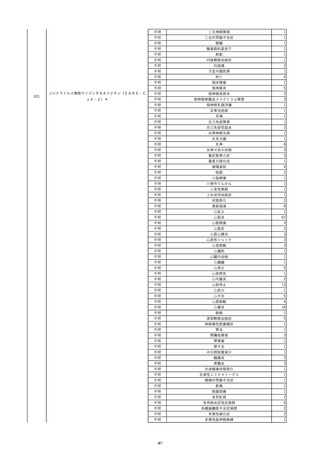
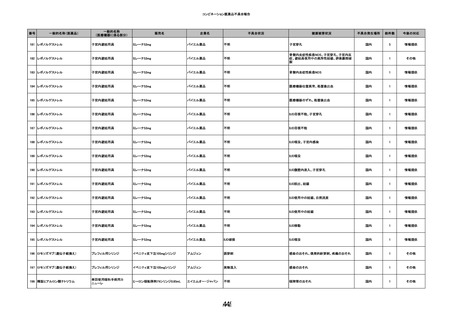
12
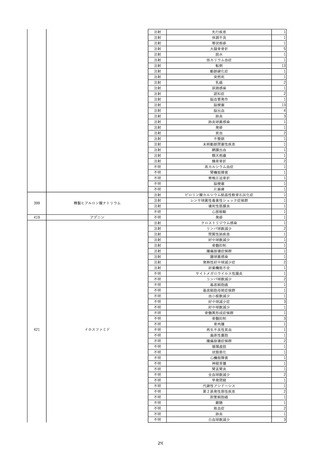
照射赤血球液-LR(人赤血球液(放
2022/6/28
射線照射))
女
70 血液疾患
細菌感染
22/06
輸血前 BT 36.5℃、BP 130/59 mmHg、HR
67 /min、SpO2 98%。
輸血3日後 BT 37.5℃、BP 80/46 mmHg、HR 70 /min、SpO2 96%(O2 2 L/min)。
プロカルシトニン 10 ng/mL以上。
セフェピム塩酸塩投与終了。
輸血4日後 BT 37.7℃、BP 103/52 mmHg、HR 74 /min、SpO2 96%(O2 2 L/min)。
メロペネム投与開始。
輸血5日後 BT 37.1℃、BP 138/79 mmHg、HR 66 /min、SpO2 98%(O2 2 L/min)。
輸血6日後 BT 37.1℃、BP 139/65 mmHg、HR 64 /min、SpO2 96%(O2 2 L/min)。
輸血7日後 BT 37.2℃、BP 108/70 mmHg、HR 60 /min、SpO2 99%(O2 2 L/min)。
輸血2日後実施の患者血液培養検査よりAcinetobacter ursingii を同定。
輸血8日後 BT 37.3℃、BP 146/67 mmHg、HR 64 /min、SpO2 99%(O2 2 L/min)。
13
14
2022/7/1
2022/7/13
照射赤血球液-LR(人赤血球液(放
射線照射))
照射赤血球液-LR(人赤血球液(放
射線照射))
男
男
HBsAg(-)
(22/01)
肝・胆・膵疾患
肝・胆・膵疾患
80 肝・胆・膵疾患
その他の疾患
その他の疾患
B型肝炎
血液腫瘍
循環器腫瘍
B型肝炎
80
21/1222/02
HBsAb(-)、HBcAb(-)
(21/12)
HBsAg(+)
(22/06)
HBV-DNA(+)、HBeAg(+)、HBeAb(+)、IgM-HBcAb(+)
(22/06)
20/06
HBsAg(-)
(20/06)
HBsAg(+)、HBsAb(-)、HBcAb(+)
(21/12)
調査中
調査中
HBV-DNA(+)、HBsAg(+)、HBsAb(-)、HBcAb(+)、HBeAg(+)、HBeAb(-)
(22/07)
2本輸血開始。
BT 36.8℃、BP 146 mmHg、HR 55 /min。
バイタル測定3時間19分後 BT 37.0℃。
2本輸血終了。
バイタル測定4時間9分後 発熱あり。BT 37.9℃、BP 124 mmHg、HR 76 /min。
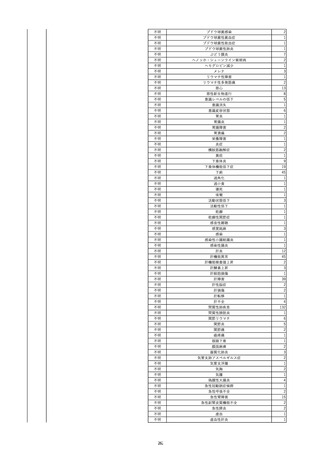
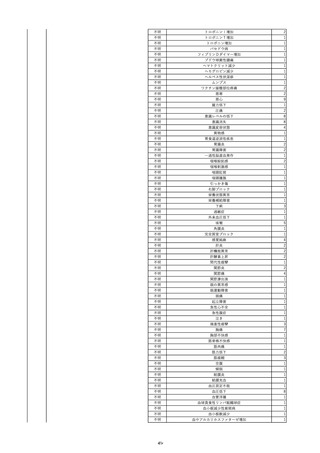
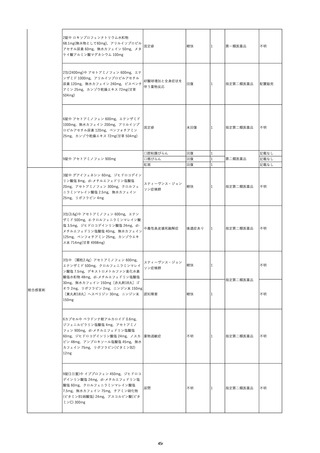
15
2022/7/14
照射赤血球液-LR(人赤血球液(放
射線照射))
男
90
その他の疾患
消化器疾患
菌血症
22/07
輸血翌日 BT 38.5℃、BP 105/47 mmHg、HR 70 /min。
輸血前 BT 36.2℃、BP 138 mmHg、HR 44
血液培養検査実施。アセトアミノフェン投与。
/min。
当該輸血用血液の使用済みバッグ内残渣の浮遊液(2本)にて細菌培養試験
を実施中。
-
-
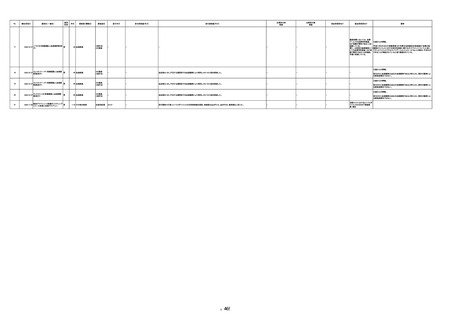
当該製品に使用されている原
料血漿は、各種ウイルス検査
が陰性である登録されたド
ナーから採取されている。
原料血漿供給元である採血
センターでは、供血者毎に血
清学的検査によりHCV抗体が
陰性であることを確認してい
る。
ミニプール血漿及び製造プー
ル血漿においては、NATによ
りHCVが陰性であることを確
認している。
輸血2日後 BT 37.4℃、BP 83/50 mmHg、HR 71 /min。
輸血3日後 BT 36.6℃、BP 117/63 mmHg、HR 72 /min。
輸血翌日実施の患者血液培養検査よりメチシリン感受性黄色ブドウ球菌を同定。
輸血4日後 BT 36.5℃、BP 119/64 mmHg、HR 91 /min。
HCV(抗C型肝炎ウイルス)-Ⅱ抗体:0.13(単位、基準値未報告)
(21/12)
HCV-Ⅱ抗体:19.72(単位、基準値未報告)
(22/06)
16
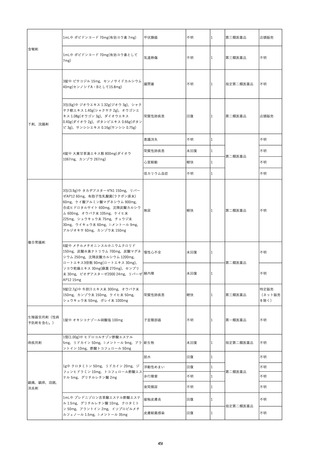
2022/6/23 アルブミナー(人血清アルブミン)
男
50 消化器疾患
急性C型肝炎 21/12
Anti-HCV:0.14(単位、基準値未報告)
(21/12)
Anti-HCV:19.72(単位、基準値未報告)
(22/06)
HCV(C型肝炎ウイルス)核酸定量/リアル:6.4LogⅠ(基準値未報告)
(22/06)
HCV RNA:6.4(単位、基準値未報告)
(22/06)
2
468
-
-
当該製品の製造工程中には、60℃、10時間液状加熱処理(パスツリゼーショ
ン)等のウイルス除去・不活化工程が組み込まれている。
また、製造工程におけるウイルス除去・不活化を確認するために、モデルウ
イルスを用いたウイルスバリデーション試験を行い、「血漿分画製剤のウイル
ス安全対策について」(平成15年11月7日付 厚生労働省医薬食品局 4課長
連名通知 第1107001号)において、ウイルスが十分に除去・不活化されてい
ると判断されたウイルスクリアランス指数9以上が得られることを確認してい
る。