よむ、つかう、まなぶ。
資料2 βーガラクトシダーゼ(アスペルギルス)、βーガラクトシダーゼ(ペニシリウム) (2 ページ)
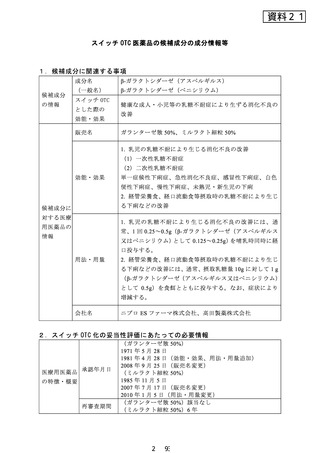
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198111_00021.html |
| 出典情報 | 医療用から要指導・一般用への転用に関する評価検討会議(第23回 12/26)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
再審査結果
通知日
再審査結果
開発の経緯
(インタビ
ューフォー
ム等より)
(ガランターゼ散 50%)該当なし
(ミルラクト細粒 50%)1993 年 9 月 8 日
(ガランターゼ散 50%)該当なし
(ミルラクト細粒50%)薬事法第14条第2項各号のいずれに
も該当しない。
(ガランターゼ散 50%) 1 )
乳幼児の下痢に関する症例が Durand(1958 年)や Holzel
(1959 年)らにより発表されて以来、乳糖分解酵素ラクタ
ー ゼ の 低 下 又 は 欠 損 が 注 目 さ れ た 。 こ の 病 型 は 1962 年
Durand により、lactose intolerance(乳糖不耐症)と名付け
られ、一次性(先天性)と胃腸炎や細菌感染に伴う二次性
の乳糖分解酵素欠損症があることが判明した。
この乳糖不耐症の治療法は、食事療法が第一選択となるが、
乳児にとっては乳糖が唯一の糖質であることから消化酵素
としての乳糖分解酵素の開発が望まれていた。
この乳糖に起因する乳児乳糖不耐症の消化改善を目的とし
て、1965 年より東京田辺製薬(株)
(現:田辺三菱製薬(株))
では自然界より分離した Aspergillus 属より酸性側に至適
pH を持つ β-ガラクトシダーゼ産生菌のスクリーニングを
進めた。その結果、pH4.0~7.5 の範囲で安定な耐酸性 β-ガ
ラクトシダーゼを主成分とする乳糖分解酵素製剤ガランタ
ーゼを開発した。
本剤は、Aspergillus oryzae T-420 の培養抽出液より精製した
β-ガラクトシダーゼ製剤で、乳児下痢症に対する二重盲検
比較試験等において有用性が認められたことを踏まえ、
1970 年 6 月に承認申請を行い、1971 年 5 月に承認を取得し
1972 年 1 月より発売を開始した。その後、1981 年 4 月に
「経管栄養食、経口流動食など摂取時の乳糖不耐により生
ずる下痢などの改善」の効能・効果追加承認を取得した。
(ミルラクト細粒 50%) 2 )
β-D-ガラクトシダーゼが乳糖不耐症の治療薬として注目さ
れて以来、アスペルギルス・オリーゼ産生の乳糖分解酵素
〔一般名:β-ガラクトシダーゼ(アスペルギルス)、以下 AspGl と略す〕製剤が開発、市販されているが、作用 pH 域が
狭く、また温度・湿度に対しても不安定であり、更に用時
に水や調整ミルクに溶けにくい等の難点があるとされてい
る。
塩野義製薬株式会社は、クミアイ化学工業株式会社によっ
て発見されたペニシリウム・マルチカラー産生の β-D-ガラ
クトシダーゼ〔一般名:β-ガラクトシダーゼ(ペニシリウ
ム)〕が Asp-Gl に比べて、作用 pH 域が広く、また温度安定
性がよく、室温保存が可能であることを確認し、共同開発
に着手した。
1978 年 6 月から薬効薬理試験を開始し、1980 年 7 月から第
I 相臨床試験を実施し、安全性を確認した。次いで、経管栄
養食、経口流動食等摂取時の乳糖不耐症に対し、第 II 相臨
床試験を行い、本剤は乳糖 10g に対し 1g で有効であること
を確認した。
3 / 93
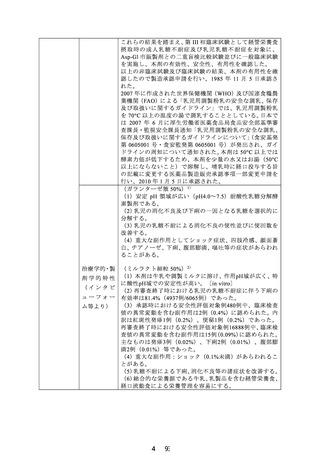
通知日
再審査結果
開発の経緯
(インタビ
ューフォー
ム等より)
(ガランターゼ散 50%)該当なし
(ミルラクト細粒 50%)1993 年 9 月 8 日
(ガランターゼ散 50%)該当なし
(ミルラクト細粒50%)薬事法第14条第2項各号のいずれに
も該当しない。
(ガランターゼ散 50%) 1 )
乳幼児の下痢に関する症例が Durand(1958 年)や Holzel
(1959 年)らにより発表されて以来、乳糖分解酵素ラクタ
ー ゼ の 低 下 又 は 欠 損 が 注 目 さ れ た 。 こ の 病 型 は 1962 年
Durand により、lactose intolerance(乳糖不耐症)と名付け
られ、一次性(先天性)と胃腸炎や細菌感染に伴う二次性
の乳糖分解酵素欠損症があることが判明した。
この乳糖不耐症の治療法は、食事療法が第一選択となるが、
乳児にとっては乳糖が唯一の糖質であることから消化酵素
としての乳糖分解酵素の開発が望まれていた。
この乳糖に起因する乳児乳糖不耐症の消化改善を目的とし
て、1965 年より東京田辺製薬(株)
(現:田辺三菱製薬(株))
では自然界より分離した Aspergillus 属より酸性側に至適
pH を持つ β-ガラクトシダーゼ産生菌のスクリーニングを
進めた。その結果、pH4.0~7.5 の範囲で安定な耐酸性 β-ガ
ラクトシダーゼを主成分とする乳糖分解酵素製剤ガランタ
ーゼを開発した。
本剤は、Aspergillus oryzae T-420 の培養抽出液より精製した
β-ガラクトシダーゼ製剤で、乳児下痢症に対する二重盲検
比較試験等において有用性が認められたことを踏まえ、
1970 年 6 月に承認申請を行い、1971 年 5 月に承認を取得し
1972 年 1 月より発売を開始した。その後、1981 年 4 月に
「経管栄養食、経口流動食など摂取時の乳糖不耐により生
ずる下痢などの改善」の効能・効果追加承認を取得した。
(ミルラクト細粒 50%) 2 )
β-D-ガラクトシダーゼが乳糖不耐症の治療薬として注目さ
れて以来、アスペルギルス・オリーゼ産生の乳糖分解酵素
〔一般名:β-ガラクトシダーゼ(アスペルギルス)、以下 AspGl と略す〕製剤が開発、市販されているが、作用 pH 域が
狭く、また温度・湿度に対しても不安定であり、更に用時
に水や調整ミルクに溶けにくい等の難点があるとされてい
る。
塩野義製薬株式会社は、クミアイ化学工業株式会社によっ
て発見されたペニシリウム・マルチカラー産生の β-D-ガラ
クトシダーゼ〔一般名:β-ガラクトシダーゼ(ペニシリウ
ム)〕が Asp-Gl に比べて、作用 pH 域が広く、また温度安定
性がよく、室温保存が可能であることを確認し、共同開発
に着手した。
1978 年 6 月から薬効薬理試験を開始し、1980 年 7 月から第
I 相臨床試験を実施し、安全性を確認した。次いで、経管栄
養食、経口流動食等摂取時の乳糖不耐症に対し、第 II 相臨
床試験を行い、本剤は乳糖 10g に対し 1g で有効であること
を確認した。
3 / 93