よむ、つかう、まなぶ。
資料2 βーガラクトシダーゼ(アスペルギルス)、βーガラクトシダーゼ(ペニシリウム) (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198111_00021.html |
| 出典情報 | 医療用から要指導・一般用への転用に関する評価検討会議(第23回 12/26)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
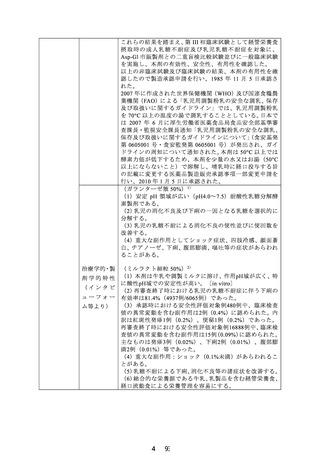
これらの結果を踏まえ、第 III 相臨床試験として経管栄養食
摂取時の成人乳糖不耐症及び乳児乳糖不耐症を対象に、
Asp-Gl 市販製剤との二重盲検比較試験並びに一般臨床試験
を実施し、本剤の有効性、安全性、有用性を確認した。
以上の非臨床試験及び臨床試験の結果、本剤の有用性を確
認したので製造承認申請を行い、1985 年 11 月 5 日承認さ
れた。
2007 年に作成された世界保健機関(WHO)及び国連食糧農
業機関(FAO)による「乳児用調製粉乳の安全な調乳、保存
及び取扱いに関するガイドライン」では、乳児用調製粉乳
を 70°C 以上の温度の湯で調乳することとしている。日本で
は 2007 年 6 月に厚生労働省医薬食品局食品安全部基準審
査課長・監視安全課長通知「乳児用調製粉乳の安全な調乳、
保存及び取扱いに関するガイドラインについて」
(食安基発
第 0605001 号・食安監発第 0605001 号)が発出され、ガイ
ドラインの周知について通知された。本剤は 50°C 以上では
酵素力価が低下するため、本剤を少量の水又はお湯(50°C
以上にならないこと)で溶解し、哺乳時に経口投与する旨
の記載に変更する医薬品製造販売承認事項一部変更申請を
行い、2010 年 1 月 5 日に承認された。
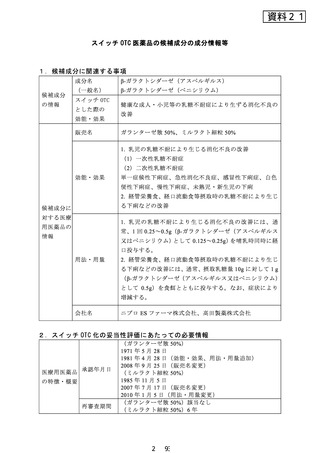
(ガランターゼ散 50%) 1 )
(1)安定 pH 領域が広い(pH4.0~7.5)耐酸性乳糖分解酵
素製剤である。
(2)乳児の消化不良及び下痢の一因となる乳糖を選択的に
分解する。
(3)乳児の乳糖不耐による消化不良の便性並びに便回数を
改善する。
(4)重大な副作用としてショック症状、四肢冷感、顔面蒼
白、チアノーゼ、下痢、腹部膨満、嘔吐等の症状があらわれ
ることがある。
治療学的・製
剤学的特性
(インタビ
ューフォー
ム等より)
(ミルラクト細粒 50%) 2 )
(1)本剤は牛乳や調製ミルクに溶け、作用pH域が広く、特
に酸性pH域での安定性が高い。〔in vitro〕
(2)再審査終了時における乳児の乳糖不耐症に伴う下痢の
有効率は81.4%(4937例/6065例)であった。
(3)承認時における安全性評価対象例480例中、臨床検査
値の異常変動を含む副作用は2例(0.4%)に認められた。内
訳は紅斑性発疹1例(0.2%)、便秘1例(0.2%)であった。
再審査終了時における安全性評価対象例16888例中、臨床検
査値の異常変動を含む副作用は15例(0.09%)に認められた。
主なものは発疹3例(0.02%)、下痢2例(0.01%)、腹部膨
満2例(0.01%)等であった。
(4)重大な副作用:ショック(0.1%未満)があらわれるこ
とがある。
(5)乳糖不耐による下痢、消化不良等の諸症状を改善する。
(6)総合的な栄養源である牛乳、乳製品を含む経管栄養食、
経口流動食による栄養管理を容易にする。
4 / 93
摂取時の成人乳糖不耐症及び乳児乳糖不耐症を対象に、
Asp-Gl 市販製剤との二重盲検比較試験並びに一般臨床試験
を実施し、本剤の有効性、安全性、有用性を確認した。
以上の非臨床試験及び臨床試験の結果、本剤の有用性を確
認したので製造承認申請を行い、1985 年 11 月 5 日承認さ
れた。
2007 年に作成された世界保健機関(WHO)及び国連食糧農
業機関(FAO)による「乳児用調製粉乳の安全な調乳、保存
及び取扱いに関するガイドライン」では、乳児用調製粉乳
を 70°C 以上の温度の湯で調乳することとしている。日本で
は 2007 年 6 月に厚生労働省医薬食品局食品安全部基準審
査課長・監視安全課長通知「乳児用調製粉乳の安全な調乳、
保存及び取扱いに関するガイドラインについて」
(食安基発
第 0605001 号・食安監発第 0605001 号)が発出され、ガイ
ドラインの周知について通知された。本剤は 50°C 以上では
酵素力価が低下するため、本剤を少量の水又はお湯(50°C
以上にならないこと)で溶解し、哺乳時に経口投与する旨
の記載に変更する医薬品製造販売承認事項一部変更申請を
行い、2010 年 1 月 5 日に承認された。
(ガランターゼ散 50%) 1 )
(1)安定 pH 領域が広い(pH4.0~7.5)耐酸性乳糖分解酵
素製剤である。
(2)乳児の消化不良及び下痢の一因となる乳糖を選択的に
分解する。
(3)乳児の乳糖不耐による消化不良の便性並びに便回数を
改善する。
(4)重大な副作用としてショック症状、四肢冷感、顔面蒼
白、チアノーゼ、下痢、腹部膨満、嘔吐等の症状があらわれ
ることがある。
治療学的・製
剤学的特性
(インタビ
ューフォー
ム等より)
(ミルラクト細粒 50%) 2 )
(1)本剤は牛乳や調製ミルクに溶け、作用pH域が広く、特
に酸性pH域での安定性が高い。〔in vitro〕
(2)再審査終了時における乳児の乳糖不耐症に伴う下痢の
有効率は81.4%(4937例/6065例)であった。
(3)承認時における安全性評価対象例480例中、臨床検査
値の異常変動を含む副作用は2例(0.4%)に認められた。内
訳は紅斑性発疹1例(0.2%)、便秘1例(0.2%)であった。
再審査終了時における安全性評価対象例16888例中、臨床検
査値の異常変動を含む副作用は15例(0.09%)に認められた。
主なものは発疹3例(0.02%)、下痢2例(0.01%)、腹部膨
満2例(0.01%)等であった。
(4)重大な副作用:ショック(0.1%未満)があらわれるこ
とがある。
(5)乳糖不耐による下痢、消化不良等の諸症状を改善する。
(6)総合的な栄養源である牛乳、乳製品を含む経管栄養食、
経口流動食による栄養管理を容易にする。
4 / 93