よむ、つかう、まなぶ。
【資料5】薬事分科会における確認事項 (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_30459.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第7回 1/26)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
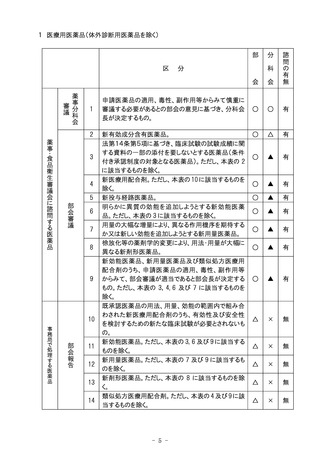
8 再生医療等製品
部
区
会
会
諮
問
の
有
無
○
○
有
○
△
有
科
分
申請再生医療等製品の構成細胞、導入遺伝子、
構造、効能、効果、性能、用法、用量、使用方法、
不具合等からみて慎重に審議する必要があるとの
部会の意見に基づき、分科会長が決定するもの
(条件及び期限を付して承認される場合は、当該条
件及び期限並びに期限の延長を含む。)。
申請再生医療等製品の構成細胞、導入遺伝子、
構造、効能、効果、性能、用法、用量、使用方法
等が既存再生医療等製品と明らかに異なり、新規
性を有するもの(条件及び期限を付して承認される
場合は、当該条件及び期限並びに期限の延長を含
む。)。
分
薬
事
・
食
品
衛
生
審
議
会
に
諮
問
す
る
再
生
医
薬
事
分
科
会
審
議
1
部
会
審
議
2
事
務
局
で
処
理
製 す
品 る
再
生
医
療
等
部
会
報
告
3
新再生医療等製品。ただし、本表の2及び4に該当
するものを除く。
△
×
無
4
構成細胞、導入遺伝子、構造、効能、効果、性
能、用法、用量、使用方法等について、既承認再
生医療等製品との相違が軽微である再生医療等
製品。
×
×
無
療
等
製
品
事
で務
処局
理の
み
注)○印は審議、△印は報告、▲印は文書配布による報告、×印は審議・報告なしを示す。
- 12 -
部
区
会
会
諮
問
の
有
無
○
○
有
○
△
有
科
分
申請再生医療等製品の構成細胞、導入遺伝子、
構造、効能、効果、性能、用法、用量、使用方法、
不具合等からみて慎重に審議する必要があるとの
部会の意見に基づき、分科会長が決定するもの
(条件及び期限を付して承認される場合は、当該条
件及び期限並びに期限の延長を含む。)。
申請再生医療等製品の構成細胞、導入遺伝子、
構造、効能、効果、性能、用法、用量、使用方法
等が既存再生医療等製品と明らかに異なり、新規
性を有するもの(条件及び期限を付して承認される
場合は、当該条件及び期限並びに期限の延長を含
む。)。
分
薬
事
・
食
品
衛
生
審
議
会
に
諮
問
す
る
再
生
医
薬
事
分
科
会
審
議
1
部
会
審
議
2
事
務
局
で
処
理
製 す
品 る
再
生
医
療
等
部
会
報
告
3
新再生医療等製品。ただし、本表の2及び4に該当
するものを除く。
△
×
無
4
構成細胞、導入遺伝子、構造、効能、効果、性
能、用法、用量、使用方法等について、既承認再
生医療等製品との相違が軽微である再生医療等
製品。
×
×
無
療
等
製
品
事
で務
処局
理の
み
注)○印は審議、△印は報告、▲印は文書配布による報告、×印は審議・報告なしを示す。
- 12 -