よむ、つかう、まなぶ。
【資料5】薬事分科会における確認事項 (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_30459.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第7回 1/26)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
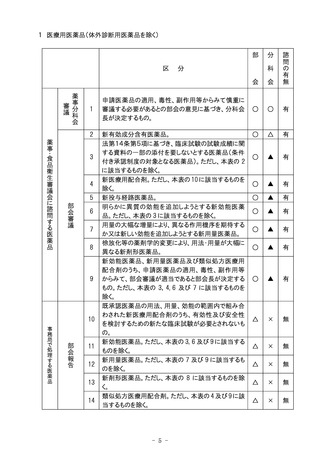
びこれに準ずるもの)の一部改正(医薬品各条の制定、改正等)については、部会審議、
分科会報告の扱いとし、全面改正(基準の廃止、制定)の場合は部会審議、分科会審
議の扱いとする。
6.生物由来製品の指定(医薬品医療機器等法第2条第10項及び第11項に規定するも
の)の、個別品目の一部追加については、品目の承認に係る審議と同様の審議区分に
おいて部会審議、分科会審議又は報告の扱いとし、全面改正の場合は、部会審議、分
科会審議、一部変更については、部会審議、分科会報告の扱いとする。
7.医療機器のクラス分類及び特定保守管理医療機器の指定(医薬品医療機器等法第2
条第5項から第8項までに規定するもの)の、個別品目の一部追加については、品目の
承認に係る審議と同様の審議区分において部会審議、分科会審議又は報告の扱いとし、
全面改正の場合は、部会審議、分科会審議、一部変更については、部会審議、分科会
報告の扱いとする。
8.医療機器及び体外診断用医薬品の基準(医薬品医療機器等法第41条第3項に定め
るもの)の一部改正については、部会審議、分科会報告の扱いとし、全面改正(基準の
廃止、制定)の場合は、部会審議、分科会審議の扱いとする。
9.一般用医薬品の区分の指定及びその変更(医薬品医療機器等法第36条の7第3項に
規定するもの)については、部会審議、分科会報告の扱いとする。
10.分科会における「審議」、「報告」の扱いの区別のうち、「報告」は事後報告(答申後)で
差し支えないこととする。
11.分科会審議の対象となる医療用医薬品(体外診断薬を除く。)、医療機器及び再生医
療等製品のうち、社会的関心の極めて高いものについては、主要な資料の概要を公表
し、広く一般の意見を求め、これを添えて分科会における審議の参考とする。
○ 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律に基づき審議会
に報告するものの取扱い
1.医薬品医療機器等法第68条の12第1項に基づく報告については、医薬品等安全対
策部会及び医療機器・再生医療等製品安全対策部会審議、薬事分科会報告の扱いと
する。
2.医薬品医療機器等法第68条の14第2項に基づく報告については、医療機器・再生医
療等製品安全対策部会審議、薬事分科会報告の扱いとする。
3.医薬品医療機器等法第68条の24第2項に基づく報告については、血液事業部会、医
薬品等安全対策部会及び医療機器・再生医療等製品安全対策部会審議、薬事分科
会報告の扱いとする。
- 2 -
分科会報告の扱いとし、全面改正(基準の廃止、制定)の場合は部会審議、分科会審
議の扱いとする。
6.生物由来製品の指定(医薬品医療機器等法第2条第10項及び第11項に規定するも
の)の、個別品目の一部追加については、品目の承認に係る審議と同様の審議区分に
おいて部会審議、分科会審議又は報告の扱いとし、全面改正の場合は、部会審議、分
科会審議、一部変更については、部会審議、分科会報告の扱いとする。
7.医療機器のクラス分類及び特定保守管理医療機器の指定(医薬品医療機器等法第2
条第5項から第8項までに規定するもの)の、個別品目の一部追加については、品目の
承認に係る審議と同様の審議区分において部会審議、分科会審議又は報告の扱いとし、
全面改正の場合は、部会審議、分科会審議、一部変更については、部会審議、分科会
報告の扱いとする。
8.医療機器及び体外診断用医薬品の基準(医薬品医療機器等法第41条第3項に定め
るもの)の一部改正については、部会審議、分科会報告の扱いとし、全面改正(基準の
廃止、制定)の場合は、部会審議、分科会審議の扱いとする。
9.一般用医薬品の区分の指定及びその変更(医薬品医療機器等法第36条の7第3項に
規定するもの)については、部会審議、分科会報告の扱いとする。
10.分科会における「審議」、「報告」の扱いの区別のうち、「報告」は事後報告(答申後)で
差し支えないこととする。
11.分科会審議の対象となる医療用医薬品(体外診断薬を除く。)、医療機器及び再生医
療等製品のうち、社会的関心の極めて高いものについては、主要な資料の概要を公表
し、広く一般の意見を求め、これを添えて分科会における審議の参考とする。
○ 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律に基づき審議会
に報告するものの取扱い
1.医薬品医療機器等法第68条の12第1項に基づく報告については、医薬品等安全対
策部会及び医療機器・再生医療等製品安全対策部会審議、薬事分科会報告の扱いと
する。
2.医薬品医療機器等法第68条の14第2項に基づく報告については、医療機器・再生医
療等製品安全対策部会審議、薬事分科会報告の扱いとする。
3.医薬品医療機器等法第68条の24第2項に基づく報告については、血液事業部会、医
薬品等安全対策部会及び医療機器・再生医療等製品安全対策部会審議、薬事分科
会報告の扱いとする。
- 2 -