よむ、つかう、まなぶ。
【資料5】薬事分科会における確認事項 (15 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_30459.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第7回 1/26)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
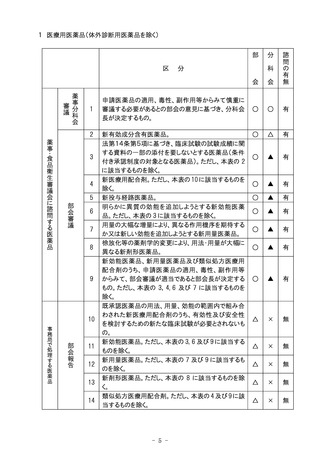
9の2 動物用医薬品及び動物用再生医療等製品の再審査及び再評価
調
区
分
部
会
会
会
諮
問
の
有
無
査
分
科
再審査期間
の延長
再審査期間の延長に係る意見を述べること。
○
○
△
有
再評価指定
再評価指定に係る意見を述べること。
○
○
△
有
品質、有効性及び安全性の問題から、承認の取
り消しが必要と認められるもの。
○
○
△
有
*
○
○
△
有
*
○
△
×
無
○
×
×
無
調
部
分
再
審
査
及
び
再
評
価
対
象
品
目
の
審
議
1
2
3
4
品質、有効性及び安全性の問題から、承認事
項の一部変更が必要と認められるもの。ただし、
本表3に該当するものを除く。
品質、有効性及び安全性の問題から、承認事
項の一部変更が必要と認められるもののうち、効
能又は効果(性能、効能又は効果)の名称の適
正化等の整備をするもの。
上記の1~3以外のもの。
注)○印は審議、△印は報告、×印は審議・報告なしを示す。
*印は承認事項の一部変更又は取り消しの審議の際に諮問が行われる。
10 動物用体外診断用医薬品
区
分
1 測定項目又は原理が新しいもの。
2 その他。
注)○印は審議、△印は報告、×印は審議・報告なしを示す。
- 15 -
会
会
会
諮
問
の
有
無
○
×
△
×
×
×
無
無
査
科
調
区
分
部
会
会
会
諮
問
の
有
無
査
分
科
再審査期間
の延長
再審査期間の延長に係る意見を述べること。
○
○
△
有
再評価指定
再評価指定に係る意見を述べること。
○
○
△
有
品質、有効性及び安全性の問題から、承認の取
り消しが必要と認められるもの。
○
○
△
有
*
○
○
△
有
*
○
△
×
無
○
×
×
無
調
部
分
再
審
査
及
び
再
評
価
対
象
品
目
の
審
議
1
2
3
4
品質、有効性及び安全性の問題から、承認事
項の一部変更が必要と認められるもの。ただし、
本表3に該当するものを除く。
品質、有効性及び安全性の問題から、承認事
項の一部変更が必要と認められるもののうち、効
能又は効果(性能、効能又は効果)の名称の適
正化等の整備をするもの。
上記の1~3以外のもの。
注)○印は審議、△印は報告、×印は審議・報告なしを示す。
*印は承認事項の一部変更又は取り消しの審議の際に諮問が行われる。
10 動物用体外診断用医薬品
区
分
1 測定項目又は原理が新しいもの。
2 その他。
注)○印は審議、△印は報告、×印は審議・報告なしを示す。
- 15 -
会
会
会
諮
問
の
有
無
○
×
△
×
×
×
無
無
査
科