よむ、つかう、まなぶ。
【資料5】薬事分科会における確認事項 (20 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_30459.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第7回 1/26)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
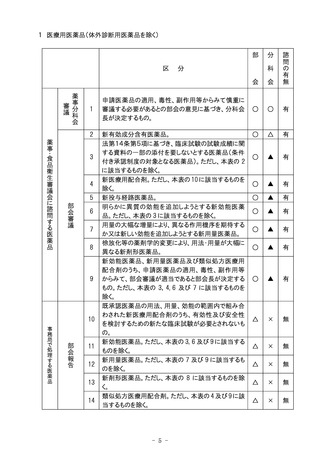
14 安全な血液製剤の安定供給の確保等に関する法律に基づく措置等
部
会
会
諮
問
の
有
無
1
安全な血液製剤の安定供給の確保等に関する法律(昭和31年法律
第160号。以下本表において「血液法」という。)第9条第4項に基づく
基本方針の策定又は変更。
○
△
有
2
血液法第10条第4項に基づく献血推進計画の策定又は変更。
○
△
有
3
血液法第11条第4項及び第6項に基づく献血受入計画の策定又は変
更の認可。
○
△
有
4
血液法第13条第4項に基づく業として行う採血の許可。
○
△
有
○
△
有
△
×
無
区
5
6
分
血液法第14条第2項に基づく事業の休廃止(本表の 6 に該当するもの
を除く)。
血液法第14条第2項に基づく事業の休廃止のうち、当該事業の休止
又は廃止によって著しく公益を害するおそれがないと認められるもの。
分
科
7
血液法第26条第5項に基づく需給計画の策定又は変更。
○
△
有
8
血液法第27条第4項に基づく需給計画の実施状況。
△
×
無
9
血液法第30条に基づく生物由来製品(血液製剤に限る。)の評価のう
ち、必要があると認めるもの。
○
△
有
10
血液法第30条に基づく生物由来製品(血液製剤に限る。)の評価(上
記の 9 に該当するものを除く)。
△
×
無
11
その他。
×
×
無
注)○印は審議、△印は報告、×印は審議・報告なしを示す。
- 20 -
部
会
会
諮
問
の
有
無
1
安全な血液製剤の安定供給の確保等に関する法律(昭和31年法律
第160号。以下本表において「血液法」という。)第9条第4項に基づく
基本方針の策定又は変更。
○
△
有
2
血液法第10条第4項に基づく献血推進計画の策定又は変更。
○
△
有
3
血液法第11条第4項及び第6項に基づく献血受入計画の策定又は変
更の認可。
○
△
有
4
血液法第13条第4項に基づく業として行う採血の許可。
○
△
有
○
△
有
△
×
無
区
5
6
分
血液法第14条第2項に基づく事業の休廃止(本表の 6 に該当するもの
を除く)。
血液法第14条第2項に基づく事業の休廃止のうち、当該事業の休止
又は廃止によって著しく公益を害するおそれがないと認められるもの。
分
科
7
血液法第26条第5項に基づく需給計画の策定又は変更。
○
△
有
8
血液法第27条第4項に基づく需給計画の実施状況。
△
×
無
9
血液法第30条に基づく生物由来製品(血液製剤に限る。)の評価のう
ち、必要があると認めるもの。
○
△
有
10
血液法第30条に基づく生物由来製品(血液製剤に限る。)の評価(上
記の 9 に該当するものを除く)。
△
×
無
11
その他。
×
×
無
注)○印は審議、△印は報告、×印は審議・報告なしを示す。
- 20 -