よむ、つかう、まなぶ。
03【資料1-1】新型コロナワクチンの接種について (27 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_31559.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会(第45回 3/7)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
【1】今後の接種について (3)小児に対する接種について
①
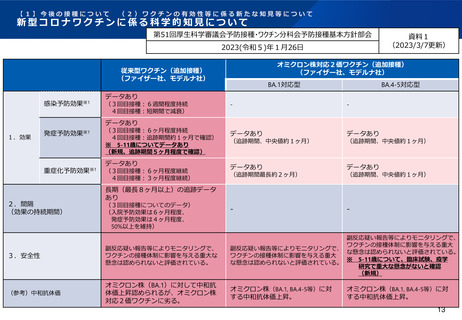
オミクロン株対応2価ワクチンの有効性、安全性及び諸外国等の状況について
第90回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、
令和4年度第23回薬事・食品衛生審議会薬事分科会医薬品等安
全対策部会安全対策調査会(合同開催)
2023(令和5)年1月20日
資料
1-6
(改)
参 考 : 我 が 国 で の 小 児 ( 5 - 1 1 歳 ) に 対 す る 従 来 型 ワ ク チ ン の 安 全 性 (2023/1/20 副反応検討部会)
ファイザー社(5-11歳用)ワクチン
集計期間
2022年2月21日2022年12月18日
推定接種回数
1回目
2回目
3回目
1,719,342接種
1,641,474接種
508,900接種
医療機関報告数(報告頻度)
製造販売業者報告数(報告頻度)
副反応疑い報告 うち重篤報告
うち死亡報告 副反応疑い報告
副反応疑い報告
副反応疑い報告
うち死亡報告
副反応疑い報告
副反応疑い報告
副反応疑い報告
うち重篤報告 うち死亡報告
うち死亡報告
副反応疑い報告
83(0.0048%)
46(0.0028%)
10(0.0020%)
18(0.0010%)
16(0.0010%)
4(0.0008%)
0(
0%)
1(0.0001%)
2(0.0004%)
107(0.0062%)
53(0.0032%)
8(0.0016%)
うち死亡報告
うち死亡報告
うち死亡報告
うち死亡報告
0(
0%)
1(0.0001%)
2(0.0004%)
備考
(推定接種回数)2022年2月21日~
2022年12月18日これまでのワクチ
ン総接種回数(12/18時点)を記載
(首相官邸Webサイト(12/21時点
掲載データ参照))
https://www.kantei.go.jp/jp/headlin
e/kansensho/vaccine.html
最新の小児(5-11歳用)ワクチン接種後の報告状況の整理
○
副反応疑い報告制度において、 2022年12月18日までに小児(5-11歳用)ワクチン接種後の副反応疑いとして報告された事例は以下
のとおりであった。
【医療機関報告】
1回目接種 83件(0.0048%)
2回目接種 46件(0.0028%)
3回目接種 10件(0.0020%)
【製造販売業者報告】
1回目接種 107件(0.0062%)
2回目接種 53件(0.0032%)
3回目接種
8件(0.0016%)
であり、死亡として報告された事例は、2回目及び3回目接種後1件及び2件(それぞれ100万回接種あたり0.6件、3.9件)であった。
○ 疑い報告の症状名は、発熱、けいれん発作等であった。
○ 心筋炎・心膜炎に係る製造販売業者からの報告例は、以下の通りであった。
【心筋炎】
1回目接種 ブライトン分類1-5 3件(100万回接種あたり1.7件)ブライトン分類1-3 1件(100万回接種あたり0.6件)
2回目接種 ブライトン分類1-5 4件(100万回接種あたり2.4件)ブライトン分類1-3 0件(100万回接種あたり 0件)
3回目接種 ブライトン分類1-5 0件(100万回接種あたり 0件)ブライトン分類1-3 0件(100万回接種あたり 0件)
【心膜炎】
1回目接種 ブライトン分類1-5 2件(100万回接種あたり1.2件)ブライトン分類1-3 1件(100万回接種あたり0.6件)
2回目接種 ブライトン分類1-5 0件(100万回接種あたり 0件)ブライトン分類1-3 0件(100万回接種あたり 0件)
3回目接種 ブライトン分類1-5 0件(100万回接種あたり 0件)ブライトン分類1-3 0件(100万回接種あたり 0件)
※ブライトン分類1-5:すべての疑い報告事例、ブライトン分類1-3:心筋炎又は心膜炎と評価された事例
小児ワクチン接種に関するまとめ
○ 小児(5-11歳用)ワクチン接種後の報告状況について、現時点においては、引き続き、ワクチンの接種体制に影響
27
を与える程の重大な懸念は認められないと考えてよい。
①
オミクロン株対応2価ワクチンの有効性、安全性及び諸外国等の状況について
第90回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、
令和4年度第23回薬事・食品衛生審議会薬事分科会医薬品等安
全対策部会安全対策調査会(合同開催)
2023(令和5)年1月20日
資料
1-6
(改)
参 考 : 我 が 国 で の 小 児 ( 5 - 1 1 歳 ) に 対 す る 従 来 型 ワ ク チ ン の 安 全 性 (2023/1/20 副反応検討部会)
ファイザー社(5-11歳用)ワクチン
集計期間
2022年2月21日2022年12月18日
推定接種回数
1回目
2回目
3回目
1,719,342接種
1,641,474接種
508,900接種
医療機関報告数(報告頻度)
製造販売業者報告数(報告頻度)
副反応疑い報告 うち重篤報告
うち死亡報告 副反応疑い報告
副反応疑い報告
副反応疑い報告
うち死亡報告
副反応疑い報告
副反応疑い報告
副反応疑い報告
うち重篤報告 うち死亡報告
うち死亡報告
副反応疑い報告
83(0.0048%)
46(0.0028%)
10(0.0020%)
18(0.0010%)
16(0.0010%)
4(0.0008%)
0(
0%)
1(0.0001%)
2(0.0004%)
107(0.0062%)
53(0.0032%)
8(0.0016%)
うち死亡報告
うち死亡報告
うち死亡報告
うち死亡報告
0(
0%)
1(0.0001%)
2(0.0004%)
備考
(推定接種回数)2022年2月21日~
2022年12月18日これまでのワクチ
ン総接種回数(12/18時点)を記載
(首相官邸Webサイト(12/21時点
掲載データ参照))
https://www.kantei.go.jp/jp/headlin
e/kansensho/vaccine.html
最新の小児(5-11歳用)ワクチン接種後の報告状況の整理
○
副反応疑い報告制度において、 2022年12月18日までに小児(5-11歳用)ワクチン接種後の副反応疑いとして報告された事例は以下
のとおりであった。
【医療機関報告】
1回目接種 83件(0.0048%)
2回目接種 46件(0.0028%)
3回目接種 10件(0.0020%)
【製造販売業者報告】
1回目接種 107件(0.0062%)
2回目接種 53件(0.0032%)
3回目接種
8件(0.0016%)
であり、死亡として報告された事例は、2回目及び3回目接種後1件及び2件(それぞれ100万回接種あたり0.6件、3.9件)であった。
○ 疑い報告の症状名は、発熱、けいれん発作等であった。
○ 心筋炎・心膜炎に係る製造販売業者からの報告例は、以下の通りであった。
【心筋炎】
1回目接種 ブライトン分類1-5 3件(100万回接種あたり1.7件)ブライトン分類1-3 1件(100万回接種あたり0.6件)
2回目接種 ブライトン分類1-5 4件(100万回接種あたり2.4件)ブライトン分類1-3 0件(100万回接種あたり 0件)
3回目接種 ブライトン分類1-5 0件(100万回接種あたり 0件)ブライトン分類1-3 0件(100万回接種あたり 0件)
【心膜炎】
1回目接種 ブライトン分類1-5 2件(100万回接種あたり1.2件)ブライトン分類1-3 1件(100万回接種あたり0.6件)
2回目接種 ブライトン分類1-5 0件(100万回接種あたり 0件)ブライトン分類1-3 0件(100万回接種あたり 0件)
3回目接種 ブライトン分類1-5 0件(100万回接種あたり 0件)ブライトン分類1-3 0件(100万回接種あたり 0件)
※ブライトン分類1-5:すべての疑い報告事例、ブライトン分類1-3:心筋炎又は心膜炎と評価された事例
小児ワクチン接種に関するまとめ
○ 小児(5-11歳用)ワクチン接種後の報告状況について、現時点においては、引き続き、ワクチンの接種体制に影響
27
を与える程の重大な懸念は認められないと考えてよい。