よむ、つかう、まなぶ。
資料2-4 ワクチンの安全性に関する評価について[3.0MB] (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_33888.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第1回 6/29)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
*
【研究開発課題名(AMED):予防接種情報とレセプトデータの連結データベースの構築およ
び既存ワクチンの有効性・安全性に関する疫学的・医療経済学評価に関する研究開発(研
究代表者 康永秀生)
】
○このことを踏まえ、肺塞栓症について、国内のコロナウイルス修飾ウリジン
RNA ワクチン(SARS-CoV-2)接種後の副反応疑い報告を基に検討を行った。
○令和3年2月 17 日から令和5年1月 22 日までの期間において、製造販売業
者から報告された肺塞栓症に係る副反応疑い報告は、コロナウイルス修飾ウ
リジン RNA ワクチン(SARS-CoV-2)各剤の合計として 192 例報告されている。
○複数の解析条件で O/E 解析を実施したところ、全ての解析条件で、いずれの
性別及び年齢層においても、背景発現率と比べて報告頻度に統計学的な有意
差は見られなかった。
○米国 FDA において、高齢者を対象とした公的医療保険であるメディケアのデ
ータを用い、COVID-19 ワクチンの安全性を評価するために、ワクチン接種後
の事象の発生率と、COVID-19 パンデミック前の事象の発現率とを比較したと
ころ、コミナティ筋注接種後の肺塞栓症、急性心筋梗塞、播種性血管内凝固、
免疫性血小板減少症の潜在的なリスクが見られた。このため、追加の検討を行
ったところ、肺塞栓症のみ依然として潜在的なリスクが認められた。一方で、
背景因子(対象者が 65 歳以上、基礎疾患等のリスク因子)を調整した評価が
必要とされ、更なる検討を実施中。なお、FDA は、これらの調査結果をもって
追加の安全対策措置は行っていない Ref.1)。
○海外(米国、英国、EU)においては、現時点で、コロナウイルス修飾ウリジン
RNA ワクチン(SARS-CoV-2)接種後の肺塞栓症について、添付文書において注
意喚起はなされていない。
3.国内の副反応疑い事例の報告状況について
(1)報告状況
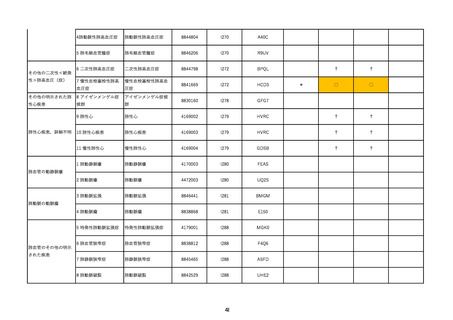
製造販売業者から報告された肺塞栓症に係る副反応疑い報告*1 は、接種開始
から令和5年1月 22 日までに下表に示すコロナウイルス修飾ウリジン RNA ワ
クチン(SARS-CoV-2)各剤の合計として 192 例の報告があり(別添1)、ワク
チンごとの報告数は下表のとおりであった。そのうち因果関係が否定できない
とされた症例(α症例)はコミナティ筋注(1 価:起源株)で1例報告されて
いる*2。
*1
ICH 国際医薬用語集(MedDRA)における基本語(以下、
「PT」)
「急性肺性心」
、
「肺梗塞」
、
「肺塞栓症」、
「肺血栓症」
、
「肺静脈血栓症」、
「肺動脈血栓症」、
「肺微小塞栓」
、
「肺高血圧
症」、「静脈血栓症」、
「静脈塞栓症」で報告された症例
2
【研究開発課題名(AMED):予防接種情報とレセプトデータの連結データベースの構築およ
び既存ワクチンの有効性・安全性に関する疫学的・医療経済学評価に関する研究開発(研
究代表者 康永秀生)
】
○このことを踏まえ、肺塞栓症について、国内のコロナウイルス修飾ウリジン
RNA ワクチン(SARS-CoV-2)接種後の副反応疑い報告を基に検討を行った。
○令和3年2月 17 日から令和5年1月 22 日までの期間において、製造販売業
者から報告された肺塞栓症に係る副反応疑い報告は、コロナウイルス修飾ウ
リジン RNA ワクチン(SARS-CoV-2)各剤の合計として 192 例報告されている。
○複数の解析条件で O/E 解析を実施したところ、全ての解析条件で、いずれの
性別及び年齢層においても、背景発現率と比べて報告頻度に統計学的な有意
差は見られなかった。
○米国 FDA において、高齢者を対象とした公的医療保険であるメディケアのデ
ータを用い、COVID-19 ワクチンの安全性を評価するために、ワクチン接種後
の事象の発生率と、COVID-19 パンデミック前の事象の発現率とを比較したと
ころ、コミナティ筋注接種後の肺塞栓症、急性心筋梗塞、播種性血管内凝固、
免疫性血小板減少症の潜在的なリスクが見られた。このため、追加の検討を行
ったところ、肺塞栓症のみ依然として潜在的なリスクが認められた。一方で、
背景因子(対象者が 65 歳以上、基礎疾患等のリスク因子)を調整した評価が
必要とされ、更なる検討を実施中。なお、FDA は、これらの調査結果をもって
追加の安全対策措置は行っていない Ref.1)。
○海外(米国、英国、EU)においては、現時点で、コロナウイルス修飾ウリジン
RNA ワクチン(SARS-CoV-2)接種後の肺塞栓症について、添付文書において注
意喚起はなされていない。
3.国内の副反応疑い事例の報告状況について
(1)報告状況
製造販売業者から報告された肺塞栓症に係る副反応疑い報告*1 は、接種開始
から令和5年1月 22 日までに下表に示すコロナウイルス修飾ウリジン RNA ワ
クチン(SARS-CoV-2)各剤の合計として 192 例の報告があり(別添1)、ワク
チンごとの報告数は下表のとおりであった。そのうち因果関係が否定できない
とされた症例(α症例)はコミナティ筋注(1 価:起源株)で1例報告されて
いる*2。
*1
ICH 国際医薬用語集(MedDRA)における基本語(以下、
「PT」)
「急性肺性心」
、
「肺梗塞」
、
「肺塞栓症」、
「肺血栓症」
、
「肺静脈血栓症」、
「肺動脈血栓症」、
「肺微小塞栓」
、
「肺高血圧
症」、「静脈血栓症」、
「静脈塞栓症」で報告された症例
2